2025年广西中考化学试题及答案
可能用到的相对原子质量:H-1C-12N-14O-16Na-23Cl-35.5Ca-40Ti-48
一、单项选择题(本大题共20小题,每小题2分,共40分。在每小题列出的四个备选项中,只有一项符合题目要求,错选、多选或未选均不得分。)
1.坚持绿色发展理念,建设美丽中国。下列做法不符合这一理念的是( )
A.随意焚烧塑料B.倡导节约用电C.开发清洁能源D.参与植树造林
2.下列标志中,表示禁止烟火的是( )

3.下列对铁片的处理方式中,容易导致其生锈的是( )
A.在表面喷漆B.制成不锈钢C.在表面涂油D.泡在海水中
4.把下列物质放入适量水中,充分搅拌,能形成溶液的是( )
A.泥沙B.蔗糖C.冰块D.植物油
5.实验室常用图1所示仪器配制溶液,该仪器的名称是( )
![]()
A.试管B.烧杯C.锥形瓶D.胶头滴管
6.防治空气污染是一项意义重大的课题。下列气体属于空气污染物的是( )
A.氮气B.氧气C.二氧化硫D.水蒸气
7.合理膳食,吃出健康。下列做法正确的是( )
A.多吃新鲜蔬菜B.多喝碳酸饮料C.多吃腌制食品D.多吃油炸食品
8.MnO2广泛应用于电极材料、磁性材料。MnO2中Mn元素的化合价为( )
A.0B.+2C.+3D.+4
9.下列广西壮族自治区博物馆的藏品中,主要由金属材料制成的是( )
A.弦纹玻璃杯B.翔鹭纹铜鼓C.工字形木器D.龙形玉饰件
10.下列实验操作正确的是( )
A.取用固体试剂B.读取液体体积C.添加酒精D.闻气味
11.青蒿素是中国传统医药献给世界的礼物。因研究青蒿素获得诺贝尔生理学或医学奖的科学家是( )
A.徐光宪B.张青莲C.屠呦呦D.袁隆平
12.下列灭火或防火的做法中,错误的是( )
A.在消防通道上乱停放车辆
B.炒菜时油锅起火,用锅盖盖灭
C.在森林和村庄间设置防火隔离带
D.堆放杂物的纸箱着火,用水浇灭
13.下列能源中,不属于新能源的是( )
A.煤B.风能C.氢能D.太阳能
14.钯广泛应用于电子电气行业。图2为钯在元素周期表中的信息。下列说法正确的是( )
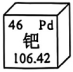
A.钯是非金属元素B.钯的元素符号为Pd
C.钯原子的质子数为60.42D.钯的相对原子质量为106.42g
15.水是生命之源。下列关于水的说法正确的是( )
A.可从海水中获得淡水
B.水资源取之不尽,用之不竭
C.水由氢气和氧气组成
D.水变成水蒸气时,分子种类发生改变
16.下列物质直接由离子构成的是( )
A.镁B.氧气C.石墨D.氯化钠
17.从香蕉皮到荧光碳量子点(纳米级碳颗粒)的制取过程中,涉及化学变化的是( )
A.切碎香蕉皮B.皮烘烤成炭C.炭研磨成粉D.炭粉加水搅拌
18.下列实验方案中,不能达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 分离铁粉和铜粉 | 用磁铁吸附 |
B | 区分羊毛制品与合成纤维 | 灼烧,闻气味 |
C | 鉴别硝酸铵和氢氧化钠固体 | 取等质量固体,加入等量水,比较温度变化 |
D | 除去一氧化碳中的氧气 | 将混合气体通过足量灼热的氧化铁 |
19.侯氏制碱法中涉及的三种物质的溶解度曲线如图3所示。下列说法正确的是( )
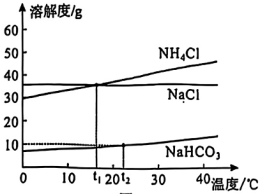
A.三种物质中,NH4Cl的溶解度最大
B.将40℃时的NaCl、NH4Cl饱和溶液分别降温至t1℃,析出晶体的质量m(NH4Cl)>m(NaCl)
C.t1℃时,取等质量的NaCl、NH4Cl固体分别溶于水配成饱和溶液,溶液的质量一定相等
D.t2℃时,10gNaHCO3固体能完全溶于50g水中
20.为测定某药片中NaHCO3的质量分数,实验小组用图4所示装置进行探究实验,实验部分数据如下表。下列说法正确的是( )
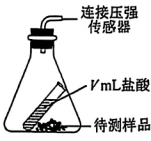
序号 | 试剂 | NaHCO3 | NaCl | NaHCO3质量分数 | 反应前后压强差 |
① | 药片(0.5g) | 未知 | 无 | 待测 | 33.6kPa |
② | NaHCO3、NaCl混合物 | 0.25g | 0.25g | 50.0% | 22.3kPa |
③ | ag | bg | 60.0% | 28.8kPa | |
④ | 0.35g | 0.15g | 70.0% | 34.2kPa |
已知:(1)药片中除NaHCO3外,其他成分不与盐酸反应。
(2)本实验所用盐酸的溶质质量分数为5.0%,密度为1.02g/cm3.
A.图4中V应不小于4.3
B.a=0.60,b=0.40
C.该药片中NaHCO3的质量分数为65.0%
D.由数据可知,压强差与NaHCO3的质量分数成正比
二、填空与简答题(本大题共6小题,除特别标注外,每空1分,共38分。)
21.(6分)用化学用语填空。
(1)氢离子____;(2)3个铝原子____;(3)2个水分子____;
(4)氯元素____;(5)金属钾____;(6)氧化镁____。
22.(6分)请用下列物质对应的序号填空。
①铝线②酒精③金刚石④氯化钾⑤浓硫酸⑥氮气
(1)可用作钾肥的是____;(2)可用于切割玻璃的是____;
(3)可用作消毒剂的是____;(4)可用作导线的是____;
(5)可用作保护气的是____;(6)可用作干燥剂的是____。
23.(6分)勤劳智慧的中国人民善于利用自然资源为生产服务。
(1)早在汉代,临邛人已使用天然气(主要成分为CH4)煮盐。CH4属于____(填“有机物”或“无机物”)。煮盐时,CH4完全燃烧的化学方程式是____(2分)。煮盐能获得盐,主要是利用了____结晶的分离方法。
(2)我国科学家已成功将CH4在室温下转化为重要的化工产品乙酸(CH3COOH),该反应的示意图如图5所示。

催化剂的质量在反应前后____(填“改变”或“不变”),图中的X是____。
24.(6分)阅读短文并回答问题。
我国古建筑的墙体多采用土或青砖筑成,砖呈青灰色主要是因为含有FeO。有些墙体表面上会长出一层“白霜”,原因之一是墙内含有的KNO3等物质受潮溶解,通过扩散作用在表面析出。现代水泥建筑墙面若渗水受潮也会出现“白霜”,研究发现,该“白霜”中含有Ca(OH)2等物质,可用稀盐酸初步处理。
(1)短文里以化学式表示的物质中,属于氧化物的是____。
(2)“白霜”的出现说明微观粒子是____(填“不断运动”或“完全静止”)的。
(3)Ca(OH)2俗称为____。“初步处理”时,稀盐酸与Ca(OH)2发生反应的化学方程式是____(2分)。
(4)保持墙体所处环境____(填“干燥”或“潮湿”),可减少“白霜”的出现。
25.(7分)废旧电池的回收利用可有效避免环境污染和资源浪费。从废锌镍电池负极片(主要成分为ZnO、Zn、铜网等)中回收ZnO的一种流程如图6所示。
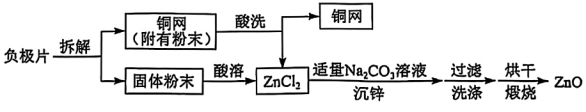
回答下列问题:
(1)“酸溶”前,将负极片变成固体粉末的目的是____。
(2)铜块能制成铜网是利用了铜的____(填“延展性”或“导热性”)。
(3)将“酸洗”和“酸溶”后的溶液混合的目的是____。
(4)“沉锌”时主要发生反应的化学方程式是Na2CO3+ZnCl2=ZnCO3↓+2NaCl,该反应属于____(填字母序号)。
A.化合反应B.分解反应C.置换反应D.复分解反应
(5)若过滤后未洗涤沉淀,沉淀表面会附着杂质,杂质的主要成分是____。
(6)铜的金属活动性比锌的____(填“强”或“弱”),结合流程说明依据:____。
26.(7分)生活中处处有化学,在家就可以体验化学的魅力。
(1)制碱:将蛋壳(主要成分为CaCO3)灼烧成灰,加水,搅拌,静置,_____(填操作名称),得到碱溶液A。灼烧时CaCO3发生反应的化学方程式是_____(2分)。
(2)制酸碱指示剂:将紫薯切碎泡水,获得的紫色溶液可做酸碱指示剂。分别向食醋、碱溶液A、苏打溶液中加入该指示剂,溶液颜色依次为红色、绿色、绿色,据此推测,苏打溶液的pH_____(填“>”或“<”)7.
(3)除锈:①将两根生锈的铁钉分别放入盛有洁厕灵(有效成分为盐酸)、食醋的塑料杯中,均能观察到铁锈溶解。从微观角度解释两者均可以除铁锈的原因是_____。
②一段时间后,两个塑料杯中都有气泡产生。用化学方程式解释盛有洁厕灵的杯中产生气泡的原因:_____(2分)。
三、实验探究题(本大题共2小题,除特别标注外,每空1分,共16分。)
27.(8分)实验是化学研究的重要手段。某同学在实验室制取氧气并进行氧气性质的探究。
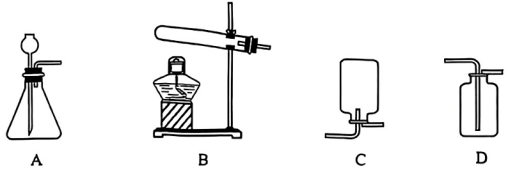
(1)该同学用双氧水和二氧化锰制取氧气,发生反应的化学方程式是_____(2分),选用的发生装置是_____(填字母序号)。
(2)实验室现有的双氧水浓度过大,使用前需要稀释。稀释双氧水时用到的玻璃仪器有胶头滴管、量筒、烧杯和_____。
(3)用排空气法收集氧气应选装置_____(填字母序号),还可以用_____法收集氧气。
(4)用带火星的木条放在集气瓶口,观察到木条_____,说明氧气已集满。将红热的铁丝伸入集满氧气的集气瓶中,铁丝剧烈燃烧,火星四射,生成_____色固体。
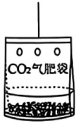
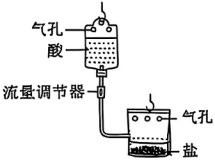
28.(8分)同学们到某蔬菜大棚基地研学,对吊挂式CO2气肥袋(如图7所示)产生了浓厚的兴趣,并对气肥袋开展了一系列探究。
查阅资料:吊挂式CO2气肥袋中含有两包试剂,分别是盐和酸,将二者放入带气孔的吊袋中混合即可使用。
I.试剂的选择
(1)实验室提供了盐酸、硫酸、碳酸钙、碳酸氢铵等四种试剂。
已知:2NH4HCO3+H2SO4=(NH4)2SO4+2CO2↑+2H2O
NH4HCO3+HCl=NH4Cl+CO2↑+H2O
同学们根据所提供的试剂,设计了如下的组合方案。
方案序号 | A | B | C | D |
组合 | 盐酸+碳酸钙 | 硫酸+碳酸钙 | 盐酸+碳酸氢铵 | _____ |
D方案的试剂组合是_____。同学们排除了B方案,因为该方案不利于CO2的制取。
【盐的选择】
(2)同学们选择A、C方案用图8所示装置进行实验探究。
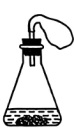
实验编号 | 实验操作 | 实验现象 |
a | 将_____、50mL溶质质量分数为5%的盐酸放入装置内 | 产生气泡,气球变大 |
b | 将2.0g碳酸氢铵粉末、50mL溶质质量分数为5%的盐酸放入装置内 | 迅速产生大量气泡,气球变得更大 |
①补全实验a的内容:_____。
②实验说明,使用碳酸氢铵效果更佳,理由是_____(2分)。
(3)有同学认为,对盐的选择还需考虑价格因素。同学们调查了这两种盐的价格。
盐 | 碳酸钙 | 碳酸氢铵 |
价格(元/kg) | 1.0 | 1.3 |
每生成88kgCO2,需要碳酸氢铵的费用为_____元,其费用比碳酸钙的稍贵。
综合(2)(3)考虑,选择碳酸氢铵更合适。
【酸的选择】
(4)盐酸具有挥发性,挥发出的HCl气体会危害植物的生长和人体的健康。因此,选择_____更合适。
II.气肥袋的使用
(5)在使用过程中,同学们发现图7所示的气肥袋有缺陷,于是设计了图9所示的气肥袋。改进后的气肥袋主要优点有_____(写出一点即可)。
(6)使用后,气肥袋中的废液应回收利用,列举出其中一种用途_____。
III.反思评价
依据以上探究,制取物质需考虑反应进行的可能性、成本高低以及产物利用等因素。
四、计算题(6分。)
29.碳化钛(TiC)具有高熔点、高硬度和高电导率的特点,在航空航天、电子工业等领域应用广泛。一种制备碳化钛的反应原理为:TiO2+3C![]() TiC+2CO↑。
TiC+2CO↑。
(1)TiC中Ti、C原子个数比为_____,Ti、C元素的质量比为_____。
(2)用该方法制备90gTiC至少需要C的质量是多少?(写出计算过程)
参考答案
一、单项选择题(本大题共20小题,每小题2分,共40分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | A | C | D | B | B | C | A | D | B | D |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | C | A | A | B | A | D | B | D | C | A |
二、填空与简答题(本大题共6小题,每个化学方程式2分,其余每空1分,共38分)
21.(5分)(1)H+ (2)3Al (3)2H2O (4)Cl (5)K (6)MgO
22.(6分)(1)④ (2)③ (3)② (4)① (5)⑥ (6)⑤
23.(6分)(1)有机物 ; CH4 + 2O2 ![]() CO2 + 2H2O (2分);蒸发; (2)不变 ; H2O
CO2 + 2H2O (2分);蒸发; (2)不变 ; H2O
24.(1) FeO (2)不断运动 (3)熟石灰(或消石灰) ; Ca(OH)?+ 2HCl = CaCl2+2H2O (2分) (4)干燥
25.(1)增大反应物接触面积,加快反应速率,使反应更充分 (2)延展性 (3)提高锌元素的利用率 (4) D (5) NaCl
(6)弱;“酸洗”时铜网表面的粉末(含Zn等)中锌能反应而铜不反应(或流程中锌能溶解在酸中,铜不能等合理依据)
26.(1)过滤;CaCO?![]() CaO +CO?↑(2) > (3)① 盐酸、食醋中都含有H+,能与铁锈(主要成分Fe2O3)反应 ;②Fe + 2HCl = FeCl? + H? ↑ (2分)
CaO +CO?↑(2) > (3)① 盐酸、食醋中都含有H+,能与铁锈(主要成分Fe2O3)反应 ;②Fe + 2HCl = FeCl? + H? ↑ (2分)
三、实验探究题(本大题共2小题,每个化学方程式2分,其余每空1分,共16分)
27. (1)2H2O2![]() 2H?O + O?↑(2分); A (2)玻璃棒 (3)D; 排水(4)复燃;黑
2H?O + O?↑(2分); A (2)玻璃棒 (3)D; 排水(4)复燃;黑
28.(1)硫酸+碳酸氢铵 (2)①2.0g碳酸钙粉末②相同条件下,碳酸氢铵与盐酸反应产生二氧化碳的速率更快、量更多(2分,合理即可) (3)26 (4)硫酸 (5)可控制反应速率(或能使反应更平稳等合理优点) (6)作化肥(或用于金属表面除锈等合理用途)
四、计算题(6分)
29.(1)1∶1 ; 4∶1 ---------------------------------(2分)
(2)解∶设至少需要C的质量为x。
TiO2 +3C![]() TiC+ 2CO ↑ ---------------------------------(1分)
TiC+ 2CO ↑ ---------------------------------(1分)
36 60
x 90g ---------------------------------(1分)
![]() -----------------------------------------------------------(1分)
-----------------------------------------------------------(1分)
x=54g-----------------------------------------------------------------(1分)
答:至少需要C的质量约为54 g。
