2025年天津中考化学试题及答案
第Ⅰ卷
注意事项:
1.每题选出答案后,用2B铅笔把“答题卡”上对应题目的答案标号的信息点涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号的信息点。
2.本卷共15题,共30分。
3.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 A1 27 S 32 Cl 35.5 Ca 40 Cu 64
一、选择题(本大题共10小题,每小题2分,共20分。每小题给出的四个选项中,只有一个最符合题意)
1.下列变化属于化学变化的是
A.粮食酿醋B.冰雪消融C.沙里淘金D.酒精挥发
2.空气是一种宝贵的自然资源,其中能供给人类呼吸的气体是
A.氮气B.氧气C.氖气D.二氧化碳
3.天津小吃煎饼果子上抹有的甜面酱中含钾、钙、钠等,这里的钾、钙、钠是指
A.元素B.原子C.分子D.单质
4.下列物质属于混合物的是
A.液态氧B.洁净的海水C.冰水混合物D.氧化镁
5.某运动饮料中含有的葡萄糖属于
A.蛋白质B.油脂C.维生素D.糖类
6.下列物质的近似pH分别是:白醋为2~3、酱油为4~5、牛奶为6~7、肥皂水为10。蚂蚁叮咬时分泌出的蚁酸使人产生痒痛,为缓解痒痛可涂抹的是
A.白醋B.酱油C.牛奶D.肥皂水
7.下列实验操作正确的是
A.引燃酒精灯 B.检验氧气
B.检验氧气
C.读取液体体积 D.倾倒液体
D.倾倒液体
8.铕元素(Eu)在元素周期表中信息如图所示。下列有关铕的说法不正确的是
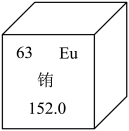
A.属于金属元素B.原子核内质子数为63
C.原子的核外电子数为89D.相对原子质量为152.0
9.下列实验现象描述正确的是
A.硫在空气中燃烧时发出蓝紫色火焰
B.铁丝插入盛有氧气的集气瓶中剧烈燃烧
C.乙醇在空气中燃烧生成二氧化碳和水
D.在空气中加热铜粉,红色粉末逐渐变为黑色
10.电解饱和食盐水的化学方程式为![]() 。下列有关说法不正确的是
。下列有关说法不正确的是
A.氢氧化钠俗称苛性钠
B.该反应中只有一种元素的化合价发生改变
C.参加反应的NaCl和![]() 的质量比为117:36
的质量比为117:36
D.反应中产生的氢气可作为理想的清洁燃料
二、选择题(本大题共5小题,每小题2分,共10分。每小题给出的四个选项中,有1~2个符合题意。只有一个选项符合题意的,多选不得分;有2个选项符合题意的,只选一个且符合题意得1分,若选2个,有一个不符合题意则不得分)
11.从化学视角对下列跨学科实践活动的描述正确的是
选项 | 实践活动 | 化学视角 |
A | 用橡皮泥制作分子模型 | 从微观粒子角度认识物质构成 |
B | 水质检测及自制净水器 | 活性炭能将天然河水净化为纯水 |
C | 设计垃圾的分类与回收利用方案 | 从物质组成、分类、转化及利用价值和保护环境等角度设计 |
D | 探究土壤酸碱性对植物生长的影响 | 用氢氧化钠改良酸性土壤 |
A.AB.BC.CD.D
12.下列分析正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.把水喷向空气中可以为养鱼池增氧,原理为增大了氧气在水中的溶解度
C.氢氧化钠固体曝露在空气中容易吸收水分,所以能用氢氧化钠干燥二氧化碳气体
D.服用含氢氧化铝![]() 的药物可以治疗胃酸过多症,原理为酸碱中和反应
的药物可以治疗胃酸过多症,原理为酸碱中和反应
13.下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 区分棉纤维和羊毛纤维 | 分别点燃,观察燃烧时的现象和产物的状态 |
B | 鉴别甲烷和一氧化碳 | 分别点燃,在火焰上方罩上用澄清石灰水润湿内壁的烧杯,观察现象 |
C | 除去一氧化碳中的二氧化碳 | 将混合气通过足量灼热的氧化铜粉末 |
D | 除去氯化钠固体中混有的少量碳酸钙 | 加适量水溶解、过滤,将滤液蒸发结晶 |
A.AB.BC.CD.D
14.下列选项中,图示实验的现象及结论正确的是
选项 | 实验图示 | 现象及结论 |
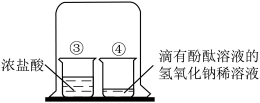
A | | 加入硝酸铵后,U形管①处液面高于②处液面,证明硝酸铵溶于水放热 |
B | | 一段时间后烧杯④中溶液的颜色由红色逐渐变浅至无色,证明③中挥发出的氯化氢气体扩散到④中,发生了中和反应 |
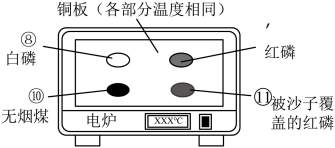
C | | 一段时间后⑤中铁钉生锈,⑥⑦中铁钉未生锈,证明铁钉生锈过程有氧气和水参加反应 |
D | | 电炉从室温升温至260℃的过程中,⑧先燃烧,⑨后燃烧,⑩?不燃烧,证明无烟煤和沙子均不是可燃物 |
A.AB.BC.CD.D
15.某混合物由![]() 和
和![]() 组成,取13.7g该混合物,向其中加入200g溶质质量分数为7.3%的稀盐酸,恰好完全反应,得到无色溶液。下列说法正确的是
组成,取13.7g该混合物,向其中加入200g溶质质量分数为7.3%的稀盐酸,恰好完全反应,得到无色溶液。下列说法正确的是
A.该混合物中![]() 的质量为5.8g
的质量为5.8g
B.该混合物中钙元素与镁元素质量比为5:9
C.反应生成的![]() 质量为1.1g
质量为1.1g
D.反应后溶液中氯元素的质量分数约为6.9%
第Ⅱ卷
注意事项:
1.用黑色字迹的签字笔将答案写在“答题卡”上。
2.本卷共11题,共70分。
3.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 A1 27 S32Cl 35.5 Ca 40 Cu 64
三、填空题(本大题共3小题,共20分)
16.化学在生产、生活中有着广泛应用。现有①稀盐酸 ②金刚石 ③氦气 ④干冰 ⑤碳酸钙 ⑥铜,选择适当的物质填空(填序号)。
(1)可用于裁玻璃的是 ;
(2)可用于除铁锈的是 ;
(3)可用于制作导线的是 ;
(4)可用于人工增雨的是 ;
(5)可用于制作霓虹灯的是 ;
(6)可用作补钙剂的是 。
17.水是生命赖以生存的重要物质。
(1)保护水资源从我做起。下列做法正确的是______(填序号)。
A.洗手后随手关闭水龙头,以节约用水
B.工业污水未经分级处理直接作为园林绿化用水
(2)下列净水方法中,采用单一操作净化程度较高的是______(填序号)。
A.吸附B.过滤C.蒸馏
(3)通过水的生成和分解实验认识水的组成。
①在空气中点燃纯净的氢气,在火焰上方罩一个干燥的烧杯,观察到烧杯内壁上出现无色液滴,写出该反应的化学方程式 。
②在如图所示电解器玻璃管中加满水,通电一段时间后,a管中产生3mL气体时,b管中产生的气体体积约为 mL。切断电源,用燃着的木条分别在玻璃管尖嘴口检验电解产生的气体,观察到 (填“a”或“b”)管中气体使木条燃烧更旺,另一管中气体可燃。
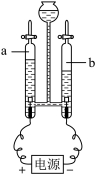
③以上实验证明水是由 两种元素组成的。
18.从多角度认识化学反应,发展科学思维。
(1)物质变化:结合以下反应的示意图回答问题。
![]()
①微观分析,反应前后发生变化的是 (填“分子”或“原子”)。
②宏观分析,该反应产生了新物质,反应的化学方程式为 。
(2)能量变化:“神舟”系列载人飞船使用的某种发动机利用了![]() 分解释放出热量和气体,反应的化学方程式为
分解释放出热量和气体,反应的化学方程式为![]() ,其中
,其中![]() 。
。
(3)调控反应:做饭时,若燃气灶的火焰呈现黄色或橙色,锅底出现黑色物质,此时需要 (填“调小”或“调大”)灶具的进风口。
(4)可持续发展:为防止燃煤烟气中的二氧化硫污染环境,可用石灰石进行脱硫,这个过程中会发生化学反应:![]() ,生成的硫酸钙可用于生产建筑材料。若吸收640t二氧化硫,至少需要碳酸钙的质量为 t。
,生成的硫酸钙可用于生产建筑材料。若吸收640t二氧化硫,至少需要碳酸钙的质量为 t。
四、简答题(本大题共3小题,共17分)
19.写出下列反应的化学方程式。
(1)硫在氧气中燃烧 ;
(2)电解水 ;
(3)二氧化碳通入足量澄清石灰水中 。
20.溶液与人类生产、生活密切相关。
(1)下表是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| 13.3 | 31.6 | 63.9 | 110 | 169 | |
①20℃时,氯化钠的溶解度为 g。
②20℃时,将20g氯化钠固体加入盛有50g水的烧杯中,充分溶解后得到的溶液质量为 g。
③60℃时,饱和硝酸钾溶液中溶质的质量分数为 (结果精确至0.1%)。
④将80℃时250g溶质的质量分数为60%的硝酸钾溶液降温到20℃,析出晶体的质量为 g。
(2)农业生产可利用质量分数为16%的氯化钠溶液选种。在实验室配制300g这种溶液,需要氯化钠的质量为 g。
21.金属及金属材料具有广泛用途
(1)铜能被加工成厚度仅为![]() 的超薄铜箔,说明铜具有良好的 (填“延展性”或“导电性”)。
的超薄铜箔,说明铜具有良好的 (填“延展性”或“导电性”)。
(2)炼铁的主要原理是一氧化碳与氧化铁在高温下反应,其化学方程式为 。
(3)将一定量的铁粉加入硝酸银和硝酸铜的混合溶液中,充分反应后过滤,得到滤渣和滤液。向滤渣中加入稀盐酸有气泡产生。则滤渣的成分为 (填化学式)。
(4)铝镁合金是飞机制造、建筑等行业的重要材料。为测定某铝镁合金(不含其他元素)中铝的质量分数,现将4.8g的铝镁合金与足量稀硫酸充分反应,生成0.5g氢气。该合金中铝的质量分数为 。
五、实验题(本大题共3小题,共23分)
22.利用下图所示实验装置制取气体,并用制得的气体进行性质实验。

(1)仪器a的名称为 。
(2)实验室用加热高锰酸钾的方法制取并收集氧气,应选用 装置(填序号),其反应的化学方程式为 。
(3)探究氧气的性质时,为使木炭与集气瓶内的氧气充分反应,用坩埚钳夹取一小块木炭,在酒精灯火焰上加热至发红,将其由瓶口向下 (填“快速”或“缓慢”)插入充满氧气的集气瓶中,观察到木炭燃烧更剧烈。
(4)实验室用石灰石和稀盐酸制取并收集二氧化碳,应选用 装置(填序号),其反应的化学方程式为 。
23.酸、碱、盐在生产、生活中有着广泛的应用。
(1)某实验小组在实验室借助pH传感器研究稀盐酸与氢氧化钠溶液的中和反应,测得实验过程中溶液pH的变化如图所示。

①该实验是将 滴入到另一种溶液中,发生反应的化学方程式为 。
②A点时,溶液中溶质为 (填化学式)。
③B点时,溶液的![]() 。
。
④取C点时的溶液,分别加入下列物质,能产生气泡的是 (填序号)。
a.铜 b.锌 c.氧化铜
(2)已知碳酸钠很稳定,受热不易发生分解;碳酸氢钠不稳定,受热容易分解,其受热分解的化学方程式:![]() 。将
。将![]() 和
和![]() 的混合物22.1g充分加热至固体质量不再改变,冷却至室温,再向其中加入150g质量分数为7.3%的稀盐酸,恰好完全反应,原混合物中
的混合物22.1g充分加热至固体质量不再改变,冷却至室温,再向其中加入150g质量分数为7.3%的稀盐酸,恰好完全反应,原混合物中![]() 的质量为 g。
的质量为 g。
24.我国科研人员研制出新型催化剂,在催化剂作用下,二氧化碳可以转化为汽油,主要转化过程如下图所示。

(1)已知反应Ⅰ中生成物为一氧化碳和水,该反应的化学方程式为 。
(2)下列关于该转化过程的说法正确的是______(填序号)。
A.反应Ⅰ属于置换反应
B.反应Ⅱ产物![]() 中C、H质量比为6:1
中C、H质量比为6:1
C.这个过程实现了从无机物到有机物的转化
D.催化剂在化工生产中具有重要作用
(3)按上图所示将176kg ![]() 转化为
转化为![]() (汽油的成分之一),整个过程中若有70%的
(汽油的成分之一),整个过程中若有70%的![]() 转化为
转化为![]() ,理论上可生成
,理论上可生成![]() 的质量为 kg。
的质量为 kg。
(4)结合上述转化过程,从反应物和生成物两个方面说明该研究成果的意义 。
六、计算题(本大题共2小题,共10分)
25.尿素![]() 是一种常见氮肥,可以促进植物茎、叶生长茂盛。计算:
是一种常见氮肥,可以促进植物茎、叶生长茂盛。计算:
(1)尿素由 种元素组成(写数值);
(2)尿素的相对分子质量为 ;
(3)120g尿素中含有氮元素的质量为 g。
26.现有一定质量的硫酸钠和硫酸铜的混合粉末,其中含钠元素2.3g。向该混合粉末中加入81.8g水,完全溶解后,逐滴滴入50g溶质质量分数为8%的氢氧化钠溶液,恰好完全反应,得到沉淀和溶液。计算:
(1)混合粉末中硫酸铜的质量;
(2)反应后所得溶液中溶质的质量分数;
(3)若用20%的氢氧化钠溶液(密度为![]() )配制上述50g质量分数为8%的氢氧化钠溶液,需要20%的氢氧化钠溶液多少毫升(
)配制上述50g质量分数为8%的氢氧化钠溶液,需要20%的氢氧化钠溶液多少毫升(![]() ;结果精确至0.1)。
;结果精确至0.1)。
参考答案
1.A
2.B
3.A
4.B
5.D
6.D
7.B
8.C
9.D
10.B
11.AC
12.D
13.AD
14.BC
15.B
16.(1)②
(2)①
(3)⑥
(4)④
(5)③
(6)⑤
17.(1)A
(2)C
(3) ![]() 6 a 氢、氧
6 a 氢、氧
18.(1) 分子 ![]()
(2)3
(3)调大
(4)1000
19.(1)![]()
(2)![]()
(3)![]()
20.(1) 36.0 68 52.4% 118.4
(2)48
21.(1)延展性
(2)![]()
(3)Ag、Cu、Fe
(4)75%
22.(1)铁架台
(2) B ![]()
(3)缓慢
(4) A ![]()
23.(1) 稀盐酸 ![]() NaCl、NaOH 7 b
NaCl、NaOH 7 b
(2)5.3
24.(1)![]()
(2)BCD
(3)37.1
(4)吸收和利用![]() ;生成汽油,减少使用化石燃料
;生成汽油,减少使用化石燃料
25.(1)4
(2)60
(3)56
26.(1)解:设混合粉末中硫酸铜的质量为x,生成氢氧化铜的质量为y,硫酸钠的质量为z。
参加反应的氢氧化钠质量:![]()

![]()
![]()
![]()
![]()
![]()
![]()
答:混合粉末中硫酸铜的质量为8g;
(2)设原混合粉末中硫酸钠的质量为m。

![]()
所得溶液中溶质的质量:![]()
所得溶液的质量:![]()
所得溶液中溶质的质量分数:![]()
答:反应后所得溶液中溶质的质量分数为10%;
(3)需要20%的氢氧化钠溶液的体积:
![]() 答:需要20%的氢氧化钠溶液16.7mL。
答:需要20%的氢氧化钠溶液16.7mL。