2025年北京高考化学真题及答案
可能用到的相对原子质量:![]()
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 我国科研人员在研究嫦娥五号返回器带回的月壤时,发现月壤钛铁矿(![]() )存在亚纳米孔道,吸附并储存了大量来自太阳风的氢原子。加热月壤钛铁矿可生成单质铁和大量水蒸气,水蒸气冷却为液态水储存起来以供使用。下列说法不正确的是
)存在亚纳米孔道,吸附并储存了大量来自太阳风的氢原子。加热月壤钛铁矿可生成单质铁和大量水蒸气,水蒸气冷却为液态水储存起来以供使用。下列说法不正确的是
A. 月壤钛铁矿中存在活泼氢
B. 将地球上开采的钛铁矿直接加热也一定生成单质铁和水蒸气
C. 月壤钛铁矿加热生成水蒸气的过程中发生了氧化还原反应
D. 将获得的水蒸气冷却为液态水的过程会放出热量
2. 下列化学用语或图示表达不正确的是
A. 乙醇的分子模型: B.
B. ![]() 的
的![]() 模型:
模型:![]()
C. S的原子结构示意图: D. 基态
D. 基态![]() 原子的价层电子排布式:
原子的价层电子排布式:![]()
3. 下列说法不正确的是
A. 糖类、蛋白质和油脂均为天然高分子B. 蔗糖发生水解反应所得产物互为同分异构体
C. 蛋白质在酶的作用下水解可得到氨基酸D. 不饱和液态植物油通过催化加氢可提高饱和度
4. 物质的微观结构决定其宏观性质。乙腈(![]() )是一种常见的有机溶剂,沸点较高,水溶性好。下列说法不正确的是
)是一种常见的有机溶剂,沸点较高,水溶性好。下列说法不正确的是
A. 乙腈的电子式: B. 乙腈分子中所有原子均在同一平面
B. 乙腈分子中所有原子均在同一平面
C. 乙腈的沸点高于与其分子量相近的丙炔D. 乙腈可发生加成反应
5. 下列反应中,体现![]() 还原性的是
还原性的是
A. ![]() 加热分解有
加热分解有![]() 生成
生成
B. ![]() 和
和![]() 的混合溶液加热有
的混合溶液加热有![]() 生成
生成
C. ![]() 固体在
固体在![]() 溶液中溶解
溶液中溶解
D. ![]() 溶液中滴加
溶液中滴加![]() 溶液出现白色沉淀
溶液出现白色沉淀
6. 下列方程式与所给事实不相符的是
A. 用盐酸除去铁锈:![]()
B. 用![]() 溶液除去乙炔中的
溶液除去乙炔中的![]()
C. 用乙醇处理废弃的![]()
D. 将![]() 通入水中制备硝酸:
通入水中制备硝酸:![]()
7. 下列实验的相应操作中,不正确的是
A.制备并检验 | B.实验室制取 |
| |
为防止有害气体逸出,先放置浸 | 实验结束时,先把导管移出水面,再熄灭酒精灯 |
C.分液 | D.蒸馏 |
| |
先打开分液漏斗上方的玻璃塞,再打开下方的活塞 | 冷却水从冷凝管①口通入,②口流出 |
A. AB. BC. CD. D
8. ![]() 时,在浓
时,在浓![]() 溶液中通入过量
溶液中通入过量![]() ,充分反应后,可通过调控温度从反应后的固液混合物中获得
,充分反应后,可通过调控温度从反应后的固液混合物中获得![]() 和
和![]() 固体。已知:
固体。已知:![]() 、
、![]() 、
、![]() 溶解度(S)随温度变化关系如下图。
溶解度(S)随温度变化关系如下图。
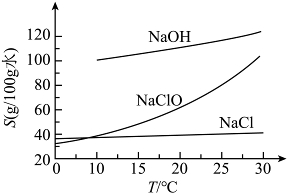
下列说法不正确的是
A. 通入![]() 后开始发生反应:
后开始发生反应:![]()
B. ![]() 时,随反应进行
时,随反应进行![]() 先析出
先析出
C. 将反应后的固液混合物过滤,滤液降温可析出![]() 固体
固体
D. 在冷却结晶的过程中,大量![]() 会和
会和![]() 一起析出
一起析出
9. 依据下列事实进行的推测正确的是
事实 | 推测 | |
A | | |
B | | |
C | 盐酸和 | 盐酸和 |
D | | |
A. AB. BC. CD. D
10. 乙烯、醋酸和氧气在钯(![]() )催化下高效合成醋酸乙烯酯(
)催化下高效合成醋酸乙烯酯(![]() )的过程示意图如下。
)的过程示意图如下。

下列说法不正确的是
A. ①中反应为![]()
B. ②中生成![]() 的过程中,有
的过程中,有![]() 键断裂与形成
键断裂与形成
C. 生成![]() 总反应的原子利用率为
总反应的原子利用率为![]()
D. ![]() 催化剂通过参与反应改变反应历程,提高反应速率
催化剂通过参与反应改变反应历程,提高反应速率
11. 为理解离子化合物溶解过程的能量变化,可设想![]() 固体溶于水的过程分两步实现,示意图如下。
固体溶于水的过程分两步实现,示意图如下。
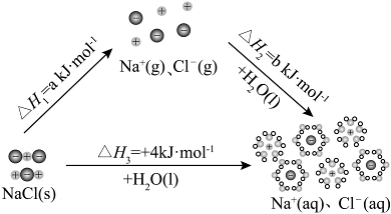
下列说法不正确的是
A. ![]() 固体溶解是吸热过程
固体溶解是吸热过程
B. 根据盖斯定律可知:![]()
C. 根据各微粒的状态,可判断![]() ,
,![]()
D. 溶解过程的能量变化,与![]() 固体和
固体和![]() 溶液中微粒间作用力的强弱有关
溶液中微粒间作用力的强弱有关
12. ![]() 研究三价铁配合物性质进行如下实验(忽略溶液体积变化)。
研究三价铁配合物性质进行如下实验(忽略溶液体积变化)。
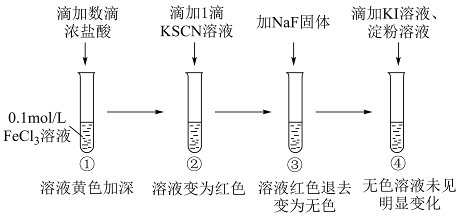
已知:![]() 为黄色、
为黄色、![]() 为红色、
为红色、![]() 为无色。
为无色。
下列说法不正确的是
A. ①中浓盐酸促进![]() 平衡正向移动
平衡正向移动
B. 由①到②,生成![]() 并消耗
并消耗![]()
C![]() ②、③对比,说明
②、③对比,说明![]() :②>③
:②>③
D. 由①→④推断,若向①深黄色溶液中加入![]() 、淀粉溶液,溶液也无明显变化
、淀粉溶液,溶液也无明显变化
13. 一种生物基可降解高分子P合成路线如下。
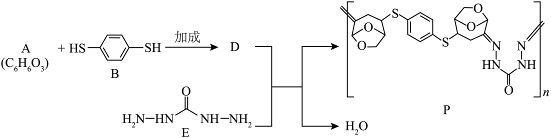
下列说法正确的是
A. 反应物A中有手性碳原子B. 反应物A与B的化学计量比是![]()
C. 反应物D与E生成P的反应类型为加聚反应D. 高分子P可降解的原因是由于![]() 键断裂
键断裂
14. 用电解![]() 溶液(图1)后的石墨电极1、2探究氢氧燃料电池,重新取
溶液(图1)后的石墨电极1、2探究氢氧燃料电池,重新取![]() 溶液并用图2装置按i→iv顺序依次完成实验。
溶液并用图2装置按i→iv顺序依次完成实验。
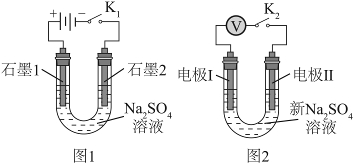
实验 | 电极I | 电极Ⅱ | 电压/V | 关系 |
i | 石墨1 | 石墨2 | a | |
ii | 石墨1 | 新石墨 | b | |
iii | 新石墨 | 石墨2 | c | |
iv | 石墨1 | 石墨2 | d |
下列分析不正确的是
A. ![]() ,说明实验i中形成原电池,反应为
,说明实验i中形成原电池,反应为![]()
B. ![]() ,是因为ii中电极Ⅱ上缺少
,是因为ii中电极Ⅱ上缺少![]() 作为还原剂
作为还原剂
C. ![]() ,说明iii中电极I上有
,说明iii中电极I上有![]() 发生反应
发生反应
D. ![]() ,是因为电极I上吸附
,是因为电极I上吸附![]() 的量:iv>iii
的量:iv>iii
第二部分
本部分共5题,共58分。
15. 通过![]() 和
和![]() 的相互转化可实现
的相互转化可实现![]() 的高效存储和利用。
的高效存储和利用。
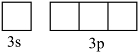
(1)将![]()
![]() 基态原子最外层轨道表示式补充完整:_______。
基态原子最外层轨道表示式补充完整:_______。
(2)![]() 分子中
分子中![]() 键角小于
键角小于![]() ,从结构角度解释原因:_______。
,从结构角度解释原因:_______。
(3)![]() 的晶胞是立方体结构,边长为
的晶胞是立方体结构,边长为![]() ,结构示意图如下。
,结构示意图如下。
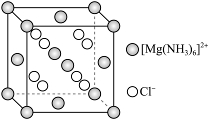
①![]() 的配体中,配位原子是_______。
的配体中,配位原子是_______。
②已知![]() 的摩尔质量为
的摩尔质量为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,该晶体的密度为_______
,该晶体的密度为_______![]() 。(
。(![]() )
)
(4)![]() 和
和![]() 反应过程中能量变化示意图如下。
反应过程中能量变化示意图如下。
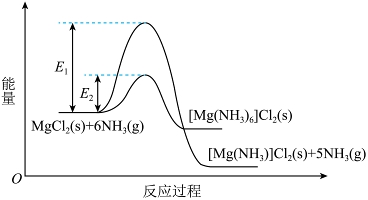
①室温下,![]() 和
和![]() 反应生成
反应生成![]() 而不生成
而不生成![]() 。分析原因:_______。
。分析原因:_______。
②从平衡的角度推断利于![]() 脱除
脱除![]() 生成
生成![]() 的条件并说明理由:_______。
的条件并说明理由:_______。
16. 铅酸电池是用途广泛并不断发展的化学电源。
(1)十九世纪,铅酸电池工作原理初步形成并延续至今。
铅酸电池工作原理:![]()
①充电时,阴极发生的电极反应为_______。
②放电时,产生a库仑电量,消耗![]() 的物质的量为_______
的物质的量为_______![]() 。已知:转移
。已知:转移![]() 电子所产生的电量为96500库仑。
电子所产生的电量为96500库仑。
③![]()
![]() 作为电解质溶液性质稳定、有较强的导电能力,
作为电解质溶液性质稳定、有较强的导电能力,![]() 参与电极反应并有利于保持电压稳定。该体系中
参与电极反应并有利于保持电压稳定。该体系中![]() 不氧化
不氧化![]() ,
,![]() 氧化性弱与其结构有关,
氧化性弱与其结构有关,![]() 的空间结构是_______。
的空间结构是_______。
④铅酸电池储存过程中,存在化学能的缓慢消耗:![]() 电极在
电极在![]() 作用下产生的
作用下产生的![]() 可将
可将![]() 电极氧化。
电极氧化。![]() 氧化
氧化![]() 发生反应的化学方程式为_______。
发生反应的化学方程式为_______。
(2)随着铅酸电池广泛应用,需要回收废旧电池材料,实现资源的再利用。回收过程中主要物质的转化关系示意图如下。

①将![]() 等物质转化为
等物质转化为![]() 的过程中,步骤I加入
的过程中,步骤I加入![]() 溶液的目的是_______。
溶液的目的是_______。
②步骤Ⅱ、Ⅲ中![]() 和
和![]() 作用分别是_______。
作用分别是_______。
(3)铅酸电池使用过程中,负极因生成导电性差的大颗粒![]() ,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有_______(填序号)。
,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有_______(填序号)。
a.增强负极导电性
b.增大负极材料比表面积,利于生成小颗粒![]()
c.碳材料作还原剂,使![]() 被还原
被还原
17. 一种受体拮抗剂中间体P合成路线如下。
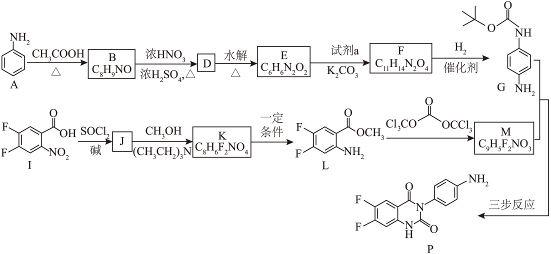
已知:①![]()
②试剂a是![]() 。
。
(1)I分子中含有的官能团是硝基和_______。
(2)B→D的化学方程式是_______。
(3)下列说法正确的是_______(填序号)。
a.试剂a的核磁共振氢谱有3组峰
b.J→K的过程中,利用了![]() 的碱性
的碱性
c.F→G与K→L的反应均为还原反应
(4)以G和M为原料合成P分为三步反应。
已知:
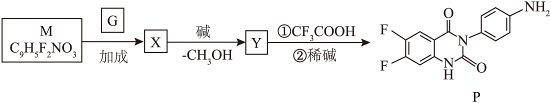
①M含有1个![]() 杂化的碳原子。M的结构简式为_______。
杂化的碳原子。M的结构简式为_______。
②Y的结构简式为_______。
(5)P的合成路线中,有两处氨基的保护,分别是:
①A→B引入保护基,D→E脱除保护基;
②_______。
18. 利用工业废气中的![]() 制备焦亚硫酸钠(
制备焦亚硫酸钠(![]() )的一种流程示意图如下。
)的一种流程示意图如下。
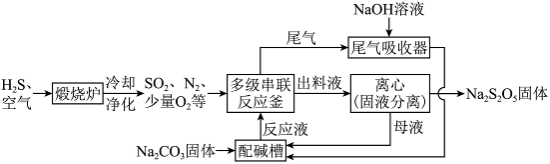
已知:
物质 | | | |
| | | |
(1)制![]()
已知:
![]()
![]()
![]()
![]()
由![]() 制
制![]() 的热化学方程式为_______。
的热化学方程式为_______。
(2)制![]()
I.在多级串联反应釜中,![]() 悬浊液与持续通入的
悬浊液与持续通入的![]() 进行如下反应:
进行如下反应:
第一步:![]()
第二步:
![]()
![]()
Ⅱ.当反应釜中溶液![]() 达到3.8~4.1时,形成的
达到3.8~4.1时,形成的![]() 悬浊液转化为
悬浊液转化为![]() 固体。
固体。
①Ⅱ中生成![]() 的化学方程式是_______。
的化学方程式是_______。
②配碱槽中,母液和过量![]() 配制反应液,发生反应的化学方程式是_______。
配制反应液,发生反应的化学方程式是_______。
③多次循环后,母液中逐渐增多的杂质离子是_______,需除去。
④尾气吸收器中,吸收的气体有_______。
(3)理论研究![]() 、
、![]() 与
与![]() 的反应。一定温度时,在
的反应。一定温度时,在![]() 浓度均为
浓度均为![]() 的
的![]() 和
和![]() 的混合溶液中,随
的混合溶液中,随![]() 的增加,
的增加,![]() 和
和![]() 平衡转化率的变化如图。
平衡转化率的变化如图。
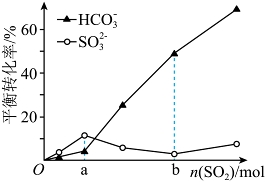
①![]() ,与
,与![]() 优先反应
优先反应![]() 离子是_______。
离子是_______。
②![]() ,
,![]() 平衡转化率上升而
平衡转化率上升而![]() 平衡转化率下降,结合方程式解释原因:_______。
平衡转化率下降,结合方程式解释原因:_______。
19. 化学反应平衡常数对认识化学反应的方向和限度具有指导意义。实验小组研究测定“![]() ”平衡常数的方法,对照理论数据判断方法的可行性。
”平衡常数的方法,对照理论数据判断方法的可行性。
(1)理论分析
①![]() 易挥发,需控制生成
易挥发,需控制生成![]() 较小。
较小。
②根据![]() 时
时![]() 分析,控制合适
分析,控制合适![]() ,可使生成
,可使生成![]() 较小;用浓度较大的
较小;用浓度较大的![]() 溶液与过量
溶液与过量![]() 反应,反应前后
反应,反应前后![]() 几乎不变;
几乎不变;![]() ,仅需测定平衡时溶液
,仅需测定平衡时溶液![]() 和
和![]() 。
。
③![]() 与水反应的程度很小,可忽略对测定干扰;低浓度
与水反应的程度很小,可忽略对测定干扰;低浓度![]() 挥发性很小,可忽略。
挥发性很小,可忽略。
(2)实验探究
序号 | 实验内容及现象 |
I | |
Ⅱ | |
Ⅲ | 测定I、Ⅱ反应后溶液的 |
已知:![]() ;
;![]() 和
和![]() 溶液颜色均为无色。
溶液颜色均为无色。
①Ⅲ中,滴定时选用淀粉作指示剂,滴定终点时的现象是_______。用离子方程式表示![]() 的作用:_______。
的作用:_______。
②I中,与反应前的溶液相比,反应后溶液的![]() _______(填“增大”、“减小”或“不变”)。平衡后,按
_______(填“增大”、“减小”或“不变”)。平衡后,按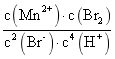 计算所得值小于
计算所得值小于![]() 的K值,是因为
的K值,是因为![]() 挥发导致计算时所用_______的浓度小于其在溶液中实际浓度。
挥发导致计算时所用_______的浓度小于其在溶液中实际浓度。
③Ⅱ中,按 计算所得值也小于
计算所得值也小于![]() 的K值,可能原因是_______。
的K值,可能原因是_______。
(3)实验改进
分析实验I、Ⅱ中测定结果均偏小的原因,改变实验条件,再次实验。
控制反应温度为![]() ,其他条件与Ⅱ相同,经实验准确测得该条件下的平衡常数。
,其他条件与Ⅱ相同,经实验准确测得该条件下的平衡常数。
①判断该实验测得![]() 平衡常数是否准确,应与_______值比较。
平衡常数是否准确,应与_______值比较。
②综合调控![]() 和温度的目的是_______。
和温度的目的是_______。
参考答案
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
【1题答案】
【答案】B
【2题答案】
【答案】C
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】B
【6题答案】
【答案】B
【7题答案】
【答案】D
【8题答案】
【答案】D
【9题答案】
【答案】D
【10题答案】
【答案】C
【11题答案】
【答案】C
【12题答案】
【答案】D
【13题答案】
【答案】A
【14题答案】
【答案】D
第二部分
本部分共5题,共58分。
【15题答案】
【答案】(1)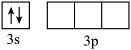 (2)CH4中碳原子的价层电子对数为4,孤电子对数为0;NH3中氮原子的价层电子对数为4,孤电子对数为1;孤电子对对成键电子对的排斥能力大于成键电子对对成键电子对的排斥能力,CH4分子中H-C-H的键角为109°28′,故NH3分子中H-N-H的键角小于109°28′
(2)CH4中碳原子的价层电子对数为4,孤电子对数为0;NH3中氮原子的价层电子对数为4,孤电子对数为1;孤电子对对成键电子对的排斥能力大于成键电子对对成键电子对的排斥能力,CH4分子中H-C-H的键角为109°28′,故NH3分子中H-N-H的键角小于109°28′
(3) ①. N ②. ![]()
(4) ①. 生成![]() 的活化能更低 ②. 根据MgCl2和NH3反应过程中的能量变化示意图可得到反应的热化学方程式为
的活化能更低 ②. 根据MgCl2和NH3反应过程中的能量变化示意图可得到反应的热化学方程式为![]() ,该反应的正反应为气体系数减小的放热反应,故低压高温有利于脱除NH3生成MgCl2。
,该反应的正反应为气体系数减小的放热反应,故低压高温有利于脱除NH3生成MgCl2。
【16题答案】
【答案】(1) ①. ![]() ②.
②. ![]() ③. 正四面体形 ④.
③. 正四面体形 ④. ![]()
(2) ①. 使硫酸铅转化为氢氧化铅,便于后续的溶解 ②. H2O2的作用为还原剂,K2S2O8的作用为氧化剂
(3)ab
【17题答案】
【答案】(1)氟原子(或碳氟键)、羧基
(2)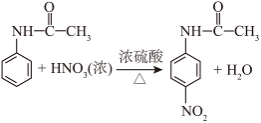 (3)bc
(3)bc
(4) ①.  ②.
②. 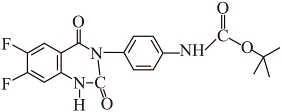
(5)E→F引入保护基,Y→P脱除保护基
【18题答案】
【答案】(1)![]()
![]()
(2) ①. ![]() ②.
②. ![]() ③.
③. ![]() ④.
④. ![]()
(3) ①. ![]() ②.
②. ![]() 时,产生的二氧化碳逸出,使反应正向进行,
时,产生的二氧化碳逸出,使反应正向进行,![]() 平衡转化率上升,亚硫酸氢根浓度增大,抑制了的亚硫酸根和二氧化硫的反应,所以
平衡转化率上升,亚硫酸氢根浓度增大,抑制了的亚硫酸根和二氧化硫的反应,所以![]() 平衡转化率上升而
平衡转化率上升而![]() 平衡转化率下降
平衡转化率下降
【19题答案】
【答案】(1) (2) ①. 滴入最后半滴![]() 标准溶液,溶液蓝色褪去,且半分钟内不恢复 ②.
标准溶液,溶液蓝色褪去,且半分钟内不恢复 ②. ![]() ③. 增大 ④.
③. 增大 ④. ![]() ⑤. 实验Ⅱ的
⑤. 实验Ⅱ的![]() 浓度低于实验Ⅰ,反应相同时间下,实验Ⅱ未达到平衡状态,导致溶液中
浓度低于实验Ⅰ,反应相同时间下,实验Ⅱ未达到平衡状态,导致溶液中![]() 偏低,计算的K值偏小
偏低,计算的K值偏小
(3) ①. 40℃下的理论K ②. 使反应更快的达到平衡状态,使Br2处于溶解平衡且挥发最少的状态,从而准确测定K值。