2025年安徽普通高中学业水平选择性考试化学试题及答案
可能用到的相对原子质量:![]()
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列有关物质用途的说法错误的是
A. 生石灰可用作脱氧剂B. 硫酸铝可用作净水剂
C. 碳酸氢铵可用作食品膨松剂D. 苯甲酸及其钠盐可用作食品防腐剂
2. 以下研究文物的方法达不到目的的是
A. 用![]() 断代法测定竹简的年代
断代法测定竹简的年代
B. 用X射线衍射法分析玉器的晶体结构
C. 用原子光谱法鉴定漆器表层的元素种类
D. 用红外光谱法测定古酒中有机分子的相对分子质量
3. 用下列化学知识解释对应劳动项目不合理的是
选项 | 劳动项目 | 化学知识 |
A | 用大米制麦芽糖 | 淀粉水解生成麦芽糖 |
B | 用次氯酸钠溶液消毒 | 次氯酸钠溶液呈碱性 |
C | 给小麦施氮肥 | 氮是小麦合成蛋白质的必需元素 |
D | 用肥皂洗涤油污 | 肥皂中的高级脂肪酸钠含有亲水基和疏水基 |
A. AB. BC. CD. D
4. 一种天然保幼激素的结构简式如下:
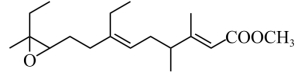
下列有关该物质的说法,错误的是
A. 分子式为![]() B. 存在4个
B. 存在4个![]() 键
键
C. 含有3个手性碳原子D. 水解时会生成甲醇
5. 氟气通过碎冰表面,发生反应①![]() ,生成的
,生成的![]() 遇水发生反应②
遇水发生反应②![]() 。下列说法正确的是
。下列说法正确的是
A. ![]() 的电子式为
的电子式为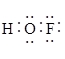 B.
B. ![]() 为非极性分子
为非极性分子
C. 反应①中有非极性键的断裂和形成D. 反应②中![]() 为还原产物
为还原产物
阅读材料,完成下列小题。
氨是其他含氨化合物的生产原料。氨可在氧气中燃烧生成![]() 。金属钠的液氨溶液放置时缓慢放出气体,同时生成
。金属钠的液氨溶液放置时缓慢放出气体,同时生成![]() 。
。![]() 遇水转化为
遇水转化为![]() 。
。![]() 溶于氨水得到深蓝色
溶于氨水得到深蓝色![]() 溶液,加入稀硫酸又转化为蓝色
溶液,加入稀硫酸又转化为蓝色![]() 溶液。氨可以发生类似于水解反应的氨解反应,浓氨水与
溶液。氨可以发生类似于水解反应的氨解反应,浓氨水与![]() 溶液反应生成
溶液反应生成![]() 沉淀。
沉淀。
6. 下列有关反应的化学方程式错误的是
A. 氨在氧气中燃烧: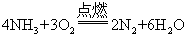
B. 液氨与金属钠反应:![]()
C. 氨水溶解![]() :
:![]()
D. 浓氨水与![]() 反应:
反应:![]()
7. 下列有关物质结构或性质的比较中,正确的是
A. 与![]() 结合的能力:
结合的能力:![]() B. 与氨形成配位键的能力:
B. 与氨形成配位键的能力:![]()
C. ![]() 和
和![]() 分子中的键长:
分子中的键长:![]() D. 微粒所含电子数:
D. 微粒所含电子数:![]()
8. 下列实验产生的废液中,可能大量存在的粒子组是
选项 | 实验 | 粒子组 |
A | 稀硝酸与铜片制 | |
B | | |
C | 浓盐酸与 | |
D | 双氧水与 | |
A. AB. BC. CD. D
9. 某化合物的结构如图所示。W、X、Y、Z是原子序数依次增大的短周期元素,其中X、Z位于同一主族。下列说法错误的是

A. 元素电负性:![]() B. 该物质中Y和Z均采取即
B. 该物质中Y和Z均采取即![]() 杂化
杂化
C. 基态原子未成对电子数:![]() D. 基态原子的第一电离能:
D. 基态原子的第一电离能:![]()
10. 下列实验操作能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 将铁制镀件与铜片分别接直流电源的正、负极,平行浸入 | 在铁制镀件表面镀铜 |
B | 向粗盐水中先后加入过量 | 粗盐提纯中,去除 |
C | 向 | 探究 |
D | 将有机物M溶于乙醇,加入金属钠 | 探究M中是否含有羟基 |
A. AB. BC. CD. D
11. 恒温恒压密闭容器中,![]() 时加入
时加入![]() ,各组分物质的量分数x随反应时间t变化的曲线如图(反应速率
,各组分物质的量分数x随反应时间t变化的曲线如图(反应速率![]() ,k为反应速率常数)。
,k为反应速率常数)。
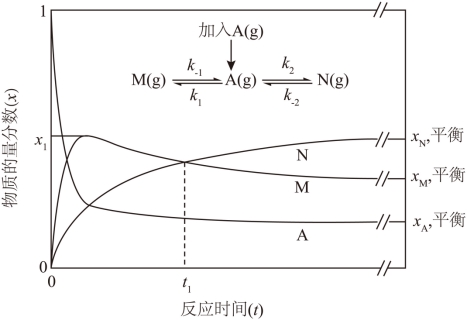
下列说法错误的是
A![]() 该条件下
该条件下![]()
B. ![]() 时间段,生成M和N的平均反应速率相等
时间段,生成M和N的平均反应速率相等
C. 若加入催化剂,![]() 增大,
增大,![]() 不变,则
不变,则![]() 和
和![]() 均变大
均变大
D. 若![]() 和
和![]() 均为放热反应,升高温度则
均为放热反应,升高温度则![]() 变大
变大
12. 碘晶体为层状结构,层间作用为范德华力,层间距为![]() 。下图给出了碘的单层结构,层内碘分子间存在“卤键”(强度与氢键相近)。
。下图给出了碘的单层结构,层内碘分子间存在“卤键”(强度与氢键相近)。![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
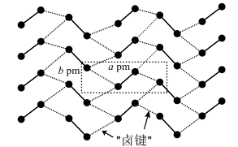
A. 碘晶体是混合型晶体B. 液态碘单质中也存在“卤键”
C. ![]() 碘晶体中有
碘晶体中有![]() 个“卤键”D. 碘晶体的密度为
个“卤键”D. 碘晶体的密度为![]()
13. 研究人员开发出一种锂-氢可充电电池(如图所示),使用前需先充电,其固体电解质仅允许![]() 通过。下列说法正确的是
通过。下列说法正确的是

A. 放电时电解质溶液质量减小
B. 放电时电池总反应为![]()
C. 充电时![]() 移向惰性电极
移向惰性电极
D. 充电时每转移![]() 电子,
电子,![]() 降低
降低![]()
14. ![]() 是二元弱酸,
是二元弱酸,![]() 不发生水解。
不发生水解。![]() 时,向足量的难溶盐
时,向足量的难溶盐![]() 粉末中加入稀盐酸,平衡时溶液中
粉末中加入稀盐酸,平衡时溶液中![]() 与
与![]() 的关系如下图所示。
的关系如下图所示。
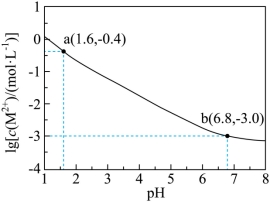
已知![]() 时,
时,![]() 。下列说法正确的是
。下列说法正确的是
A. ![]() 时,
时,![]() 的溶度积常数
的溶度积常数![]()
B. ![]() 时,溶液中
时,溶液中![]()
C. ![]() 时,溶液中
时,溶液中![]()
D. ![]() 时,溶液中
时,溶液中![]()
二、非选择题:本题共4小题,共58分。
15. 某含锶(![]() )废渣主要含有
)废渣主要含有![]() 和
和![]() 等,一种提取该废渣中锶的流程如下图所示。
等,一种提取该废渣中锶的流程如下图所示。
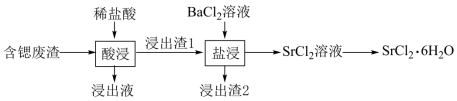
已知![]() 时,
时,![]()
回答下列问题:
(1)锶位于元素周期表第五周期第ⅡA族。基态原子价电子排布式为_______。
(2)“浸出液”中主要的金属离子有![]() 、_______(填离子符号)。
、_______(填离子符号)。
(3)“盐浸”中![]() 转化反应的离子方程式为_______;
转化反应的离子方程式为_______;![]() 时,向
时,向![]() 粉末中加入
粉末中加入![]() 溶液,充分反应后,理论上溶液中
溶液,充分反应后,理论上溶液中![]() _______
_______![]() (忽略溶液体积的变化)。
(忽略溶液体积的变化)。
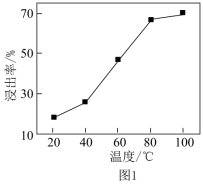
(4)其他条件相同时,盐浸![]() ,浸出温度对锶浸出率的影响如图1所示。随温度升高锶浸出率增大的原因是_______。
,浸出温度对锶浸出率的影响如图1所示。随温度升高锶浸出率增大的原因是_______。
(5)“漫出渣2”中主要含有![]() 、_______(填化学式)。
、_______(填化学式)。
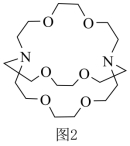
(6)将窝穴体a(结构如图2所示)与![]() 形成的超分子加入“浸出液”中,能提取其中的
形成的超分子加入“浸出液”中,能提取其中的![]() ,原因是_______。
,原因是_______。
(7)由![]() 制备无水
制备无水![]() 的最优方法是_______(填标号)。
的最优方法是_______(填标号)。
a.加热脱水 b.在![]() 气流中加热 c.常温加压 d.加热加压
气流中加热 c.常温加压 d.加热加压
16. 侯氏制碱法以![]() 、
、![]() 和
和![]() 为反应物制备纯碱。某实验小组在侯氏制碱法基础上,以
为反应物制备纯碱。某实验小组在侯氏制碱法基础上,以![]() 和
和![]() 为反应物,在实验室制备纯碱,步骤如下:
为反应物,在实验室制备纯碱,步骤如下:
①配制饱和食盐水;
②在水浴加热下,将一定量研细的![]() ,加入饱和食盐水中,搅拌,使
,加入饱和食盐水中,搅拌,使![]() ,溶解,静置,析出
,溶解,静置,析出![]() 晶体;
晶体;
③将![]() 晶体减压过滤、煅烧,得到
晶体减压过滤、煅烧,得到![]() 固体。
固体。
回答下列问题:
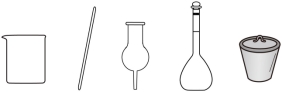
(1)步骤①中配制饱和食盐水,下列仪器中需要使用的有_______(填名称)。
(2)步骤②中![]() 需研细后加入,目的是_______。
需研细后加入,目的是_______。
(3)在实验室使用![]() 代替
代替![]() 和
和![]() 制备纯碱,优点是_______。
制备纯碱,优点是_______。
(4)实验小组使用滴定法测定了产品的成分。滴定过程中溶液的![]() 随滴加盐酸体积变化的曲线如下图所示。
随滴加盐酸体积变化的曲线如下图所示。
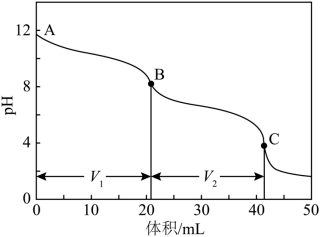
i.到达第一个滴定终点B时消耗盐酸![]() ,到达第二个滴定终点C时又消耗盐酸
,到达第二个滴定终点C时又消耗盐酸![]() 。
。![]() ,所得产品的成分为_______(填标号)。
,所得产品的成分为_______(填标号)。
a.![]() b.
b.![]() c.
c.![]() 和
和![]() d.
d.![]() 和
和![]()
ii.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓。该同学所记录的![]() _______
_______![]() (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)已知常温下![]() 和
和![]() 的溶解度分别为
的溶解度分别为![]() 和
和![]() 。向饱和
。向饱和![]() 溶液中持续通入
溶液中持续通入![]() 气体会产生
气体会产生![]() 晶体。实验小组进行相应探究:
晶体。实验小组进行相应探究:
实验 | 操作 | 现象 |
a | 将 | 无明显现象 |
b | 将 | 矿泉水瓶变瘪, |
i.实验a无明显现象的原因是_______。
ii.析出的白色晶体可能同时含有![]() 和
和![]() 。称取
。称取![]() 晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水
晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水![]() 和
和![]() 溶液,
溶液,![]() 溶液增重
溶液增重![]() ,则白色晶体中
,则白色晶体中![]() 的质量分数为_______。
的质量分数为_______。
17. I.通过甲酸分解可获得超高纯度的![]() 。甲酸有两种可能的分解反应:
。甲酸有两种可能的分解反应:
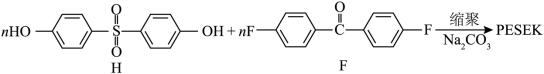
(6)制备![]() 反应中,单体之一选用芳香族氟化物F,而未选用对应的氯化物,可能的原因是_______。
反应中,单体之一选用芳香族氟化物F,而未选用对应的氯化物,可能的原因是_______。
(7)已知酮可以被过氧酸(如间氯过氧苯甲酸,![]() )氧化为酯:
)氧化为酯:
![]()
参照题干合成路线,写出以苯为主要原料制备苯甲酸苯酯(![]() )的合成路线_______(其他试剂任选)。
)的合成路线_______(其他试剂任选)。
参考答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【1题答案】
【答案】A
【2题答案】
【答案】D
【3题答案】
【答案】B
【4题答案】
【答案】B
【5题答案】
【答案】A
【6~7题答案】
【答案】6. D 7. B
【8题答案】
【答案】C
【9题答案】
【答案】D
【10题答案】
【答案】C
【11题答案】
【答案】C
【12题答案】
【答案】A
【13题答案】
【答案】C
【14题答案】
【答案】A
二、非选择题:本题共4小题,共58分。
【15题答案】
【答案】(1)![]()
(2)![]() 、
、![]()
(3) ①. ![]() ②.
②. ![]()
(4)升高温度,![]() 与
与![]() 有效碰撞次数增加,反应速率加快,所以锶浸出率增大;
有效碰撞次数增加,反应速率加快,所以锶浸出率增大;
(5)![]() 、
、![]()
(6)窝穴体a的空腔与![]() 更匹配,可通过分子间相互作用形成超分子,且
更匹配,可通过分子间相互作用形成超分子,且![]() 具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定 (7)a
具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定 (7)a
【16题答案】
【答案】(1)烧杯、玻璃棒
(2)加快![]() 溶解、加快
溶解、加快![]() 与
与![]() 反应
反应
(3)工艺简单、绿色环保、制备产品的效率较高、原料利用率较高
(4) ①. a ②. >
(5) ①. ![]() 在饱和
在饱和![]() 溶液中的溶解速率小、溶解量小,且两者发生反应的速率也较小,生成的
溶液中的溶解速率小、溶解量小,且两者发生反应的速率也较小,生成的![]() 的量较少,
的量较少,![]() 在该溶液中没有达到过饱和状态,故不能析出晶体 ②.
在该溶液中没有达到过饱和状态,故不能析出晶体 ②. ![]()
【17题答案】
【答案】(1)-41.2
(2)bc (3) ①. 原因是反应①![]() 活化能低,反应②活化能高,反应②进行的速率慢 ②. 催化剂在升温时活性降低或升温时催化剂对反应②更有利
活化能低,反应②活化能高,反应②进行的速率慢 ②. 催化剂在升温时活性降低或升温时催化剂对反应②更有利
(4)b (5) ①. 增大 ②. 0.675p2
【18题答案】
【答案】(1) ①. 酮羰基 ②. 还原反应
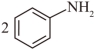
(2)
![]()
![]()
![]() ;
;
(3)![]()
(4)b (5)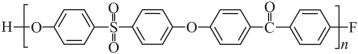
(6)电负性:F>Cl,C-F键极性更大,易断裂,且氟原子半径小,空间位阻小,更容易发生缩聚反应
(7)
