2024年黑龙江大庆中考化学真题及答案
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Ca-40 Fe-56 Cu-64 Zn-65 Ag-108
一、选择题:本题10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项符合要求。
1. 下列过程只涉及物理变化的是
A. 氧气变为液氧
B. 硫在空气里燃烧
C. 白色的硫酸铜粉末放在潮湿空气中,固体变蓝
D. 向氢氧化钠溶液中滴加紫色石蕊溶液,溶液变蓝
2. 实验操作是实验探究的基础。下列操作错误的是
A. 加速溶解 B. 加热液体
B. 加热液体
C. 蒸发食盐水 D. 二氧化碳的验满
D. 二氧化碳的验满![]()
3. 化学就在我们身边,人类的衣、食、住、行都离不开。下列说法错误的是
A. 棉花属于合成纤维
B. 葡萄糖可为人体组织提供营养
C. 水泥、玻璃等化工产品都是重要的建筑材料
D. 在汽油中加入适量乙醇,可适当节省石油资源
4. 下列分类正确的是
选项 | 酸 | 碱 | 盐 | 混合物 |
A | 醋酸 | 纯碱 | 小苏打 | 福尔马林 |
B | 碳酸 | 熟石灰 | 磷酸氢二铵 | 石油 |
C | 柠檬酸 | NH3·H2O | 高锰酸钾 | 冰水混合物 |
D | 磷酸 | KOH | 粗盐 | 石灰浆 |
A. A B. B C. C D. D
5. “端午时节粽飘香”。据研究,粽子的香味来源于粽叶中含有的对乙烯基苯酚(化学式为C8H8O)。下列说法正确的是
A. 对乙烯基苯酚中含有4个氢分子
B. 对乙烯基苯酚属于无机化合物
C. 对乙烯基苯酚由碳、氢、氧三种元素组成
D. 1个C8H8O分子含有16个原子
6. 下列化学方程式书写正确的是
A. 氧化铝溶于稀硫酸:Al2O3+2H2SO4=2AlSO4+2H2O
B. 铁溶于稀盐酸:2Fe+6HCl=2FeCl3+3H2↑
C. 氢气还原氧化铜:CuO+H2=Cu+H2O
D. 向硫酸铜溶液中滴加少量氢氧化钠溶液:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
7. 下列实验设计能达到实验目的的是
|
|
A.探究同种溶质在不同溶剂里的溶解性 | B.验证红磷的着火点比白磷的高 |
|
|
C.验证质量守恒定律 | D.测定空气中氧气的含量 |
A. A B. B C. C D. D
8. 下列图像能正确反映对应变化关系的是
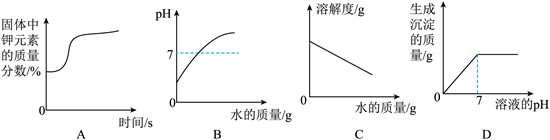
A. 加热高锰酸钾固体
B. 室温下向pH=3的稀硫酸中不断加水
C. 一定温度下,将NH4Cl饱和溶液加水稀释
D. 向Na2SO4和H2SO4的混合溶液中逐滴加入Ba(OH)2溶液
9. 如图是氯化钾、氯化铵、硝酸钾三种固体物质的溶解度曲线。下列说法错误的是
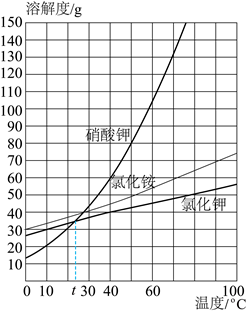
A. 三种物质中,溶解度受温度影响最大的是硝酸钾
B. 30℃时接近饱和的氯化铵溶液,增加溶质或恒温蒸发溶剂可使其变成饱和溶液
C. t℃时,硝酸钾饱和溶液和氯化钾饱和溶液中所含溶质质量相等
D. 10℃时,将硝酸钾、氯化铵、氯化钾三种物质的饱和溶液分别升温到30℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小依次为氯化铵、氯化钾、硝酸钾
10. 碳酸锂Li2CO3是制备新能源汽车电池的重要原料。下图是模拟提纯碳酸锂的工艺流程图。
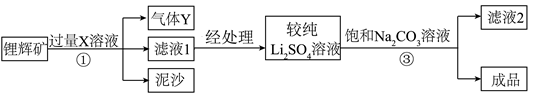
已知:Ⅰ、锂辉矿主要成分为Li2CO3,含泥沙等杂质。
Ⅱ、Li2CO3(化学性质与Na2CO3类似)为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大。
下列说法错误的是
A. X可以是稀硫酸,常用澄清石灰水检验气体Y
B. 将滤液2蒸发,当有较多固体出现时,停止加热
C. ②中适宜用冷饱和Na2CO3溶液
D. 此工艺可获得副产品Na2SO4
二、填空题:本题5小题,共30分。
11. 化学与生产、生活息息相关,请根据所学知识和生活实践回答下列问题:
(1)水是生命之源,应爱护水资源。溶有较多可溶性钙、镁化合物的水叫做______。
(2)合理施用化肥可以提高农作物产量,尿素是农业上常用的______(填“氮肥”“钾肥”“磷肥”中的任意一种)。
(3)生铁和钢是含碳量不同的两种铁合金,其中含碳量较高的是______。
(4)保护金属资源的途径:______、有计划合理地开采矿物以及寻找金属的代用品。(填写一条即可)
(5)自来水厂欲将河水转化为生活用水,处理过程的先后顺序为______。(仅填序号:①消毒②过滤③沉降④吸附)
12. 如图是实验室制取气体的常用装置,请回答下列问题:
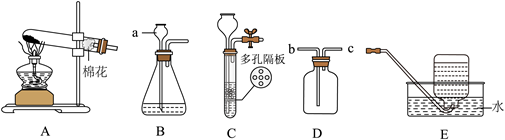
(1)仪器a的名称为______。
(2)实验室制取二氧化碳气体时,为了随时控制反应的发生或停止,发生装置应选用______(填字母)。
(3)如用D装置除去CO2中的水蒸气,D中盛放的试剂为______(填名称);如用D装置收集H2,则气体应从导管______端通入(填“b”或“c”)。
(4)NH3极易溶于水,______用E装置收集NH3(填“能”或“不能”)。
13. 如图为钡在元素周期表中的相关信息及原子结构示意图。请回答下列问题:
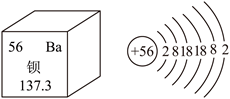
(1)钡是______元素(填“金属”或“非金属”);钡的相对原子质量为______。
(2)钠、镁、铝三种元素中______元素与钡元素位于同一族(填元素符号)。
(3)钡原子在化学变化中易______电子形成钡离子(填“得”或“失”),钡离子有毒,医疗上用“钡餐”(主要成分为BaSO4)作X射线透视胃部的内服药,但BaCO3不能用作“钡餐”的原因为______(用化学方程式解释)。
14. 氢气作为新能源。被认为具理相的清洁高能燃料。如图是用硫化氢H2S气体制备氢气的模拟工艺流程图。
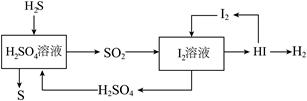
(1)将图中S、H2S、H2SO4、SO2四种物质按硫元素化合价由低到高排序:______。
(2)HCl、HNO3是一元酸,H2S、H2SO4是二元酸,写出H2S与足量NaOH溶液反应的化学方程式______。
(3)如图流程中可循环利用的物质有______(写出化学式)。
(4)人体缺碘会引起甲状腺肿大,碘是人体必需的______元素(填“常量”或“微量”)。
(5)如图为HI转化为I2的示意图,请写出如图中反应的化学方程式______。
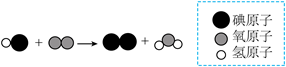
15. 碱式碳酸铜Cu2(OH)2CO3受热分解产生三种氧化物B、C、D(分解过程中所有元素化合价保持不变)。已知,常温常压下B为液体、D为气体,I为HCl,J为磁铁矿的主要成分,K和N为常见的金属单质。它们之间的转化关系如图所示(部分反应条件和产物已略去)。
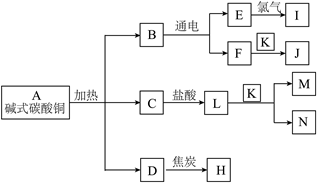
(1)写出碱式碳酸铜分解的化学方程式:______。
(2)C与盐酸发生化学反应的反应类型为______。
(3)M的化学式为______;向L和M的混合溶液中加入一定量的K,充分反应后过滤,滤渣为纯净物,则滤液中溶质的成分可能有______种情况。
(4)D与焦炭生成H的反应是______反应(填“吸热”或“放热”);反应中焦炭作______剂(填“氧化”或“还原”)。
(5)H与J反应生成K的化学方程式为______。
三、实验题:本题2小题,共22分。
16. 2024年4月25日,神舟十八号载人飞船发射成功,航天员将在中国空间站完成各项任务,保障航天员的氧气需求至关重要。那么,空间站的氧气从哪里来?
I、从地球带上去
(1)实验室常用加热氯酸钾和二氧化锰的混合物的方法制氧气,写出该反应的化学方程式:______;工业上选择空气为原料制氧气的主要原因是______。
(2)分离液态空气获得氧气的模拟实验过程如图1所示:
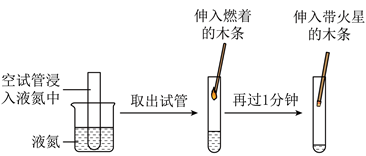
浸入液氮一段时间后,试管内产生一定体积的液态空气。取出试管,液态空气沸腾,伸入燃着的木条,木条熄灭,导致木条熄灭的原因是______;1分钟后伸入带火星的木条,观察到木条复燃,导致木条复燃的原因是______。
(3)利用分子筛可将氧分子从空气中“筛”出去,氮分子不能通过分子筛,从而获得高浓度的氧气。其原理如图,由此可知两种分子的大小:N2______O2(填“>”或“<”)。
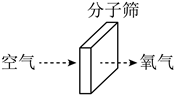
Ⅱ、在天宫制出来
(4)早期空间站利用二氧化碳和过氧化钠Na2O2反应制氧气,同时生成碳酸钠,请写出化学方程式:______。
(5)空间站内二氧化碳的主要来源是______。
(6)科学家设计了生命保障系统,实现了“水-氧-碳”的循环转化。下列叙述正确的是______(填字母)。
a.“水-氧-碳”的循环转化,减少了氧气的携带量,减轻了火箭和飞船的载重
b.若在产生氧气的同时产生其他气体,系统需要对其进行处理
c.人体代谢产物中的水既有气态又有液态,设计系统时应考虑水的冷凝与净化
17. 氢氧化钙Ca(OH)2是常见的碱,是一种白色粉末状物质。我市某化学兴趣小组在实验室研究CO2的性质时偶然发现,澄清石灰水升温时有固体析出(不考虑水的蒸发),为探究析出固体的成分,该小组同学提出以下猜想。
【猜想与假设】析出的固体是Ca(OH)2。
(1)你认为提出此猜想的依据是______。
【探究与结论】
(2)为验证此猜想,小庆同学提出实验方案:将固体过滤出,重新加水溶解配成饱和溶液,测定溶液的pH。经测定,室温下溶液的pH为12,小庆同学认为固体中存在Ca(OH)2。
小娜同学提出另一种实验方案:将升温后变浑浊的石灰水恢复至原温度,若溶液恢复澄清则证明猜想成立。但在实验过程中,发现实验现象与猜想不一致,她观察到______。因此得出实验结论:析出的固体中除了Ca(OH)2还混有少量CaCO3。你认为存在CaCO3的原因是______(用化学方程式表示)。
(3)上述实验过程中使用pH试纸测定溶液酸碱度的操作为:在玻璃片上放一小片pH试纸,______滴到pH试纸上,与标准比色卡比较,读出溶液的pH;实验过程中发现过滤速率慢,可能的原因为______(填字母)。
a.滤纸没紧贴漏斗内壁 b.固体颗粒堵塞了滤纸孔隙 c.滤纸破损
四、计算题:本题1小题,共8分。
18. 计算:
(1)小铁同学做中和反应实验,若使100.0g质量分数为3.65%的盐酸恰好完全反应,则需用托盘天平称量______gNaOH固体。
(2)向200.0g质量分数为12%的NaOH溶液中通入4.4gCO2,充分反应后,溶液中溶质的成分及质量为______。
(3)工业上制备NaOH通常采用电解饱和食盐水的方法,具体原理为:
_____NaCl+_____H2O![]() _____NaOH+_____H2↑+_____Cl2↑
_____NaOH+_____H2↑+_____Cl2↑
某化工厂用该方法制备NaOH,欲制备8吨NaOH,理论上需要多少吨NaCl固体做原料?_____(配平化学方程式并写出计算过程)
参考答案
一、选择题:本题10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项符合要求。
【1题答案】
【答案】A
【2题答案】
【答案】D
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】C
【6题答案】
【答案】D
【7题答案】
【答案】B
【8题答案】
【答案】A
【9题答案】
【答案】C
【10题答案】
【答案】C
二、填空题:本题5小题,共30分。
【11题答案】
【答案】(1)硬水 (2)氮肥
(3)生铁 (4)防止铁生锈(或金属回收利用) (5)③②④①
【12题答案】
【答案】(1)长颈漏斗
(2)C (3) ①. 浓硫酸 ②. c
(4)不能
【13题答案】
【答案】(1) ①. 金属 ②. 137.3
(2)Mg (3) ①. 失 ②. ![]()
【14题答案】
【答案】(1)H2S<S<SO2<H2SO4
(2)2NaOH+H2S=Na2S+2H2O
(3)I2、H2SO4
(4)微量 (5)4HI+O2=2I2+2H2O
【15题答案】
【答案】(1)![]()
(2)复分解反应 (3) ①. FeCl2 ②. 两
(4) ①. 吸热 ②. 还原
(5)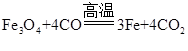
三、实验题:本题2小题,共22分。
【16题答案】
【答案】(1) ①. 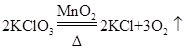 ②. 氧气占空气体积的21%,空气是廉价易得的原料,所以航天工业以空气为原料制氧。
②. 氧气占空气体积的21%,空气是廉价易得的原料,所以航天工业以空气为原料制氧。
(2) ①. 液氮的沸点低,先从液态空气中扩散出来,且氮气不能助燃 ②. 液氧的沸点高,后从液态空气中扩散出来,且氧气具有助燃性
(3)> (4)![]() (5)宇航员的呼吸作用 (6)abc
(5)宇航员的呼吸作用 (6)abc
【17题答案】
【答案】(1)氢氧化钙的溶解度随温度的升高而减小
(2) ①. 石灰水中仍有少量白色固体 ②. ![]()
(3) ①. 用玻璃棒蘸取待测液 ②. ab
四、计算题:本题1小题,共8分。
【18题答案】
【答案】(1)4 (2)溶质成分为氢氧化钠、碳酸钠,氢氧化钠的质量为16g,碳酸钠的质量为10.6g
(3) ①. 2 ②. 2 ③. 2 ④. 1 ⑤. 1 ⑥. 解:设理论上需要氯化钠固体的质量为m
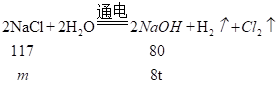
![]() m=11.7t
m=11.7t
答:理论上需要氯化钠固体的质量为11.7t。