2025年山东普通高中学业水平选择性考试化学真题及答案
可能用到的相对原子质量:![]()
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1. 下列在化学史上产生重要影响的成果中,不涉及氧化还原反应的是
A. 侯德榜发明了以![]() ,
,![]() 和
和![]() 为原料的联合制碱法
为原料的联合制碱法
B. 戴维电解盐酸得到![]() 和
和![]() ,从而提出了酸的含氢学说
,从而提出了酸的含氢学说
C. 拉瓦锡基于金属和![]() 的反应提出了燃烧的氧化学说
的反应提出了燃烧的氧化学说
D. 哈伯发明了以![]() 和
和![]() 为原料合成氨的方法
为原料合成氨的方法
2. 化学应用体现在生活的方方面面,下列用法不合理的是
A. 用明矾净化黄河水B. 用漂白粉漂白蚕丝制品
C. 用食醋去除水壶中水垢D. 用小苏打作烘焙糕点膨松剂
3. 实验室中,下列试剂保存方法正确的是
A. 液溴加水封保存在广口试剂瓶中B. 硝酸银溶液保存在棕色细口试剂瓶中
C. 高锰酸钾与苯酚存放在同一药品柜中D. 金属锂保存在盛有煤油的广口试剂瓶中
4. 称取![]() 固体
固体![]() 配制
配制![]() 浓度约为
浓度约为![]() 的
的![]() 溶液,下列仪器中不需要使用的是
溶液,下列仪器中不需要使用的是
A. ![]() 烧杯B.
烧杯B. ![]() 容量瓶
容量瓶
C. ![]() 量筒D.
量筒D. ![]() 细口试剂瓶(具橡胶塞)
细口试剂瓶(具橡胶塞)
5. 下列实验涉及反应的离子方程式书写正确的是
A. 用![]() 溶液吸收少量
溶液吸收少量![]()
B. 用![]() 和水制备少量
和水制备少量![]()
C. 用![]() 和浓盐酸制备
和浓盐酸制备![]()
D. 用稀硝酸溶解少量![]() 粉:
粉:![]()
6. 第70号元素镱![]() 的基态原子价电子排布式为
的基态原子价电子排布式为![]() 。下列说法正确的是
。下列说法正确的是
A. ![]() 的中子数与质子数之差为104B.
的中子数与质子数之差为104B. ![]() 与
与![]() 是同一种核素
是同一种核素
C![]() 基态
基态![]() 原子核外共有10个d电子D.
原子核外共有10个d电子D. ![]() 位于元素周期表中第6周期
位于元素周期表中第6周期
7. 用硫酸和![]() 可制备一元弱酸
可制备一元弱酸![]() 。下列说法错误的是
。下列说法错误的是
A. ![]() 的水溶液显碱性
的水溶液显碱性
B. ![]() 的空间构型为V形
的空间构型为V形
C. ![]() 为含有共价键的离子化合物
为含有共价键的离子化合物
D. ![]() 的中心N原子所有价电子均参与成键
的中心N原子所有价电子均参与成键
8. 物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是
|
性质差异 |
主要原因 |
|
|
A |
沸点: |
电离能: |
|
B |
酸性: |
电负性: |
|
C |
硬度:金刚石>晶体硅 |
原子半径: |
|
D |
熔点: |
离子电荷: |
A. AB. BC. CD. D
9. 用肼![]() 的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量
的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量![]() ,反应原理如图所示。下列说法正确的是
,反应原理如图所示。下列说法正确的是
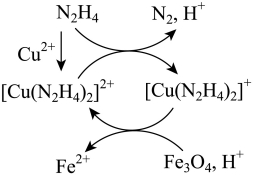
A. ![]() 是还原反应的产物B. 还原性:
是还原反应的产物B. 还原性:![]()
C. 处理后溶液的![]() 增大D. 图示反应过程中起催化作用的是
增大D. 图示反应过程中起催化作用的是![]()
10. 在恒容密闭容器中,![]() 热解反应所得固相产物和气相产物均为含氟化合物。平衡体系中各组分物质的量随温度的变化关系(实线部分)如图所示。已知:
热解反应所得固相产物和气相产物均为含氟化合物。平衡体系中各组分物质的量随温度的变化关系(实线部分)如图所示。已知:![]() 温度时,
温度时,![]() 完全分解;体系中气相产物在
完全分解;体系中气相产物在![]() 、
、![]() 温度时的分压分别为
温度时的分压分别为![]() 、
、![]() 。下列说法错误的是
。下列说法错误的是

A. a线所示物种为固相产物
B. ![]() 温度时,向容器中通入
温度时,向容器中通入![]() ,气相产物分压仍为
,气相产物分压仍为![]()
C. ![]() 小于
小于![]() 温度时热解反应的平衡常数
温度时热解反应的平衡常数![]()
D. ![]() 温度时、向容器中加入b线所示物种,重新达平衡时逆反应速率增大
温度时、向容器中加入b线所示物种,重新达平衡时逆反应速率增大
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11. 完成下列实验所用部分仪器或材料选择正确的是
|
实验内容 |
仪器或材料 |
|
|
A |
灼烧海带 |
坩埚、泥三角 |
|
B |
加热浓缩 |
表面皿、玻璃棒 |
|
C |
称量 |
电子天平、称量纸 |
|
D |
量取 |
|
A. AB. BC. CD. D
12. 全铁液流电池工作原理如图所示,两电极分别为石墨电极和负载铁的石墨电极。下列说法正确的是

A. 隔膜为阳离子交换膜
B. 放电时,a极为负极
C. 充电时,隔膜两侧溶液![]() 浓度均减小
浓度均减小
D. 理论上,![]() 每减少
每减少![]() 总量相应增加
总量相应增加![]()
13. 钢渣中富含![]() 等氧化物,实验室利用酸碱协同法分离钢渣中的
等氧化物,实验室利用酸碱协同法分离钢渣中的![]() 元素,流程如下。已知:
元素,流程如下。已知:![]() 能溶于水;
能溶于水;![]() ,
,![]() 。下列说法错误的是
。下列说法错误的是

A. 试剂X可选用![]() 粉
粉
B. 试剂Y可选用盐酸
C. “分离”后![]() 元素主要存在于滤液Ⅱ中
元素主要存在于滤液Ⅱ中
D. “酸浸”后滤液Ⅰ的![]() 过小会导致滤渣Ⅱ质量减少
过小会导致滤渣Ⅱ质量减少
14. 以异丁醛![]() 为原料制备化合物Q的合成路线如下,下列说法错误的是
为原料制备化合物Q的合成路线如下,下列说法错误的是
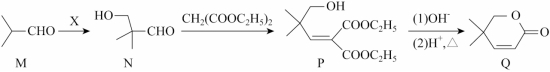
A. M系统命名为2-甲基丙醛
B. 若![]() 原子利用率为100%,则X是甲醛
原子利用率为100%,则X是甲醛
C. 用酸性![]() 溶液可鉴别N和Q
溶液可鉴别N和Q
D. ![]() 过程中有
过程中有![]() 生成
生成
15. 常温下,假设![]() 水溶液中
水溶液中![]() 和
和![]() 初始物质的量浓度均为
初始物质的量浓度均为![]() 。平衡条件下,体系中全部四种含碳物种的摩尔分数随
。平衡条件下,体系中全部四种含碳物种的摩尔分数随![]() 的变化关系如图所示(忽略溶液体积变化)。已知:体系中含钴物种的存在形式为
的变化关系如图所示(忽略溶液体积变化)。已知:体系中含钴物种的存在形式为![]() 和
和![]() ;
;![]() ,
,![]() 。下列说法正确的是
。下列说法正确的是

A. 甲线所示物种为![]()
B. ![]() 的电离平衡常数
的电离平衡常数![]()
C. ![]() 时,
时,![]() 物质的量浓度为
物质的量浓度为![]()
D. ![]() 时,物质的量浓度:
时,物质的量浓度:![]()
三、非选择题:本题共5小题,共60分。
16. ![]() 单质及其化合物应用广泛。回答下列问题:
单质及其化合物应用广泛。回答下列问题:
(1)在元素周期表中,![]() 位于第_______周期_______族。基态
位于第_______周期_______族。基态![]() 原子与基态
原子与基态![]() 离子未成对电子数之比为_______。
离子未成对电子数之比为_______。
(2)尿素分子![]() 与
与![]() 形成配离子的硝酸盐
形成配离子的硝酸盐![]() 俗称尿素铁,既可作铁肥,又可作缓释氮肥。
俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素C、N、O中,第一电离能最大的是_______,电负性最大的是_______。
②尿素分子中,C原子采取的轨道杂化方式为_______。
③八面体配离子![]() 中
中![]() 的配位数为6,碳氮键的键长均相等,则与
的配位数为6,碳氮键的键长均相等,则与![]() 配位的原子是_______(填元素符号)。
配位的原子是_______(填元素符号)。
(3)![]() 可用作合成氨催化剂、其体心立方晶胞如图所示(晶胞边长为
可用作合成氨催化剂、其体心立方晶胞如图所示(晶胞边长为![]() )。
)。

①![]() 晶胞中
晶胞中![]() 原子的半径为_______
原子的半径为_______![]() 。
。
②研究发现,![]() 晶胞中阴影所示m,n两个截面的催化活性不同,截面单位面积含有
晶胞中阴影所示m,n两个截面的催化活性不同,截面单位面积含有![]() 原子个数越多,催化活性越低。m,n截面中,催化活性较低的是_______,该截面单位面积含有的
原子个数越多,催化活性越低。m,n截面中,催化活性较低的是_______,该截面单位面积含有的![]() 原子为_______个
原子为_______个![]() 。
。
17. 采用两段焙烧—水浸法从铁锰氧化矿(要含![]() 及
及![]() 等元素的氧化物)分离提取
等元素的氧化物)分离提取![]() 等元素,工艺流程如下:
等元素,工艺流程如下:

已知:该工艺条件下,![]() 低温分解生成
低温分解生成![]() ,高温则完全分解为气体;
,高温则完全分解为气体;![]() 在
在![]() 完全分解,其他金属硫酸盐分解温度均高于
完全分解,其他金属硫酸盐分解温度均高于![]() 。
。
回答下列问题:
(1)“低温焙烧”时金属氧化物均转化为硫酸盐。![]() 与
与![]() 反应转化为
反应转化为![]() 时有
时有![]() 生成,该反应的化学方程式为_______。“高温焙烧”温度为
生成,该反应的化学方程式为_______。“高温焙烧”温度为![]() ,“水浸”所得滤渣主要成分除
,“水浸”所得滤渣主要成分除![]() 外还含有_______(填化学式)。
外还含有_______(填化学式)。
(2)在![]() 投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸时金属元素的浸出率_______(填“增大”“减小”或“不变”)。
投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸时金属元素的浸出率_______(填“增大”“减小”或“不变”)。
(3)![]() 萃取
萃取![]() 反应为:
反应为:![]() (有机相)
(有机相)![]() (水相)
(水相)![]() (有机相)
(有机相)![]() (水相)。“反萃取”时加入的试剂为_______(填化学式)。
(水相)。“反萃取”时加入的试剂为_______(填化学式)。
(4)“沉钴”中,![]() 时
时![]() 恰好沉淀完全
恰好沉淀完全![]() ,则此时溶液中
,则此时溶液中![]() _______
_______![]() 。已知:
。已知:![]() 。
。![]() “溶解”时发生反应的离子方程式为_______。
“溶解”时发生反应的离子方程式为_______。
(5)“沉锰”所得滤液并入“吸收”液中,经处理后所得产品导入_______(填操作单元名称)循环利用。
18. 如下不饱和聚酯可用于制备玻璃钢![]()

实验室制备该聚酯的相关信息和装置示意图如下(加热及夹持装置略):
|
原料 |
结构简式 |
熔点/℃ |
沸点/℃ |
|
顺丁烯二酸酐 |
|
52.6 |
202.2 |
|
邻苯二甲酸酐 |
|
130.8 |
295.0 |
|
丙-1,2-二醇 |
|
|
187.6 |

实验过程:
①在装置A中加入上述三种原料,缓慢通入![]() 。搅拌下加热,两种酸酐分别与丙-1,2-二醇发生醇解反应,主要生成
。搅拌下加热,两种酸酐分别与丙-1,2-二醇发生醇解反应,主要生成![]() 和
和 。然后逐步升温至
。然后逐步升温至![]() ,醇解产物发生缩聚反应生成聚酯。
,醇解产物发生缩聚反应生成聚酯。
②缩聚反应后期,每隔一段时间从装置A中取样并测量其酸值,直至酸值达到聚合度要求(酸值:中和1克样品所消耗![]() 的毫克数)。
的毫克数)。
回答下列问题:
(1)理论上,原料物质的量投料比n(顺丁烯二酸酐):n(邻苯二甲酸酐):n(丙-1,2-二醇)_______。
(2)装置B的作用是_______;仪器C的名称是_______;反应过程中,应保持温度计2示数处于一定范围,合理的是_______(填标号)。
A.![]() B.
B.![]() C.
C.![]()
(3)为测定酸值,取![]() 样品配制
样品配制![]() 溶液。移取
溶液。移取![]() 溶液,用
溶液,用![]() —乙醇标准溶液滴定至终点,重复实验,数据如下:
—乙醇标准溶液滴定至终点,重复实验,数据如下:
|
序号 |
1 |
2 |
3 |
4 |
5 |
|
滴定前读数/ |
0.00 |
24.98 |
0.00 |
0.00 |
0.00 |
|
滴定后读数/ |
24.98 |
49.78 |
24 |
25.00 |
25.02 |
应舍弃的数据为_______(填序号);测得该样品的酸值为_______(用含a,c的代数式表示)。若测得酸值高于聚合度要求,可采取的措施为_______(填标号)。
A.立即停止加热 B.排出装置D内的液体 C.增大![]() 的流速
的流速
(4)实验中未另加催化剂的原因是_______。
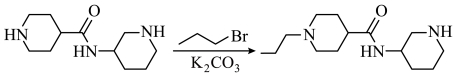
19. 麻醉药布比卡因(I)的两条合成路线如下:

已知:Ⅰ.
Ⅱ.
回答下列问题:
(1)A结构简式为_______;B中含氧官能团名称为_______。
(2)![]() 反应类型为_______;
反应类型为_______;![]() 化学方程式为_______。
化学方程式为_______。
(3)G的同分异构体中,同时满足下列条件的结构简式为_______(写出一种即可)。
①含![]() ②含2个苯环 ③含4种不同化学环境的氢原子
②含2个苯环 ③含4种不同化学环境的氢原子
(4)H中存在酰胺基N原子(a)和杂环N原子(b),N原子电子云密度越大,碱性越强,则碱性较强的N原子是_______(填“a”或“b”)。
(5)结合路线信息,用![]() 催化加氢时,下列有机物中最难反应的是_______(填标号)。
催化加氢时,下列有机物中最难反应的是_______(填标号)。
A. 苯(![]() )B. 吡啶(
)B. 吡啶(![]() )
)
C. 环已-1,3-二烯(![]() )D. 环己-1,4-二烯(
)D. 环己-1,4-二烯(![]() )
)
(6)以![]() ,
,![]() ,
,![]() 为主要原料合成
为主要原料合成 。利用上述信息补全合成路线_______。
。利用上述信息补全合成路线_______。

20. 利用![]() 循环再生可将燃煤尾气中的
循环再生可将燃煤尾气中的![]() 转化生产单质硫,涉及的主要反应如下:
转化生产单质硫,涉及的主要反应如下:
Ⅰ.![]()
Ⅱ.![]()
Ⅲ.![]()
恒容条件下,按![]() 和
和![]() 投料反应。平衡体系中,各气态物种的
投料反应。平衡体系中,各气态物种的![]() 随温度的变化关系如图所示,n为气态物种物质的量的值。
随温度的变化关系如图所示,n为气态物种物质的量的值。
已知:图示温度范围内反应Ⅱ平衡常数![]() 基本不变。
基本不变。

回答下列问题:
(1)反应![]() 的焓变
的焓变![]() _______(用含
_______(用含![]() 的代数式表示)。
的代数式表示)。
(2)乙线所示物种为_______(填化学式)。反应Ⅲ的焓变![]() _______0(填“>”“<”或“=”)。
_______0(填“>”“<”或“=”)。
(3)![]() 温度下,体系达平衡时,乙线、丙线所示物种的物质的量相等,若丁线所示物种为
温度下,体系达平衡时,乙线、丙线所示物种的物质的量相等,若丁线所示物种为![]() ,则
,则![]() 为_______
为_______![]() (用含a的代数式表示);此时,
(用含a的代数式表示);此时,![]() 与
与![]() 物质的量的差值
物质的量的差值![]() _______
_______![]() (用含a的最简代数式表示)。
(用含a的最简代数式表示)。
(4)![]() 温度下,体系达平衡后,压缩容器体积
温度下,体系达平衡后,压缩容器体积![]() 产率增大。与压缩前相比,重新达平衡时,
产率增大。与压缩前相比,重新达平衡时,![]() 与
与![]() 物质的量之比
物质的量之比![]() _______(填“增大”“减小”或“不变”),
_______(填“增大”“减小”或“不变”),![]() 物质的量
物质的量![]() _______(填“增大”“减小”或“不变”)。
_______(填“增大”“减小”或“不变”)。
参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
【1题答案】
【答案】A
【2题答案】
【答案】B
【3题答案】
【答案】B
【4题答案】
【答案】C
【5题答案】
【答案】C
【6题答案】
【答案】D
【7题答案】
【答案】B
【8题答案】
【答案】A
【9题答案】
【答案】C
【10题答案】
【答案】C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
【11题答案】
【答案】A
【12题答案】
【答案】BC
【13题答案】
【答案】A
【14题答案】
【答案】CD
【15题答案】
【答案】D
三、非选择题:本题共5小题,共60分。
【16题答案】
【答案】(1) ①. 四 ②. VIII ③. 4:5
(2) ①. N ②. O ③. sp2 ④. O
(3) ①. ![]() ②. n ③.
②. n ③. ![]()
【17题答案】
【答案】(1) ①.  ②. Fe2O3、CaSO4
②. Fe2O3、CaSO4
(2)减小 (3)H2SO4
(4) ①![]() 4×10-4 ②.
4×10-4 ②. ![]()
(5)低温焙烧
【18题答案】
【答案】(1)1:1:2
(2) ①. 导气,同时将顺丁烯二酸酐、苯二甲酸酐、丙-1,2-二醇以及醇解反应的产物冷凝回流到装置A中,但是不会将水蒸气冷凝 ②. (直形)冷凝管 ③. B
(3) ①. 2、3 ②. ![]() ③. C
③. C
(4)酸酐本身就能催化成酯反应(酰基化反应),且可以与水反应,促进缩聚反应正向进行
【19题答案】
【答案】(1) ①![]()
 ②. 羧基
②. 羧基
(2) ①. 取代反应 ②. 
(3) (4)b (5)A
(4)b (5)A
(6)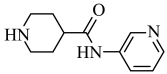
![]()
【20题答案】
【答案】(1)ΔH1+ΔH2
(2) ①. H2O ②. <
(3) ①. 0.45+0.5a ②. 150a
(4) ①. 增大 ②. 增大

