2025年广东普通高中学业水平选择性考试化学试题及答案
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Ti 48 Fe 56
一、选择题:本大题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题列出的四个选项中,只有一项符合题目要求。
1. 中华传统技艺,凸显人民智慧。下列选项所涉及材料的主要成分属于合金的是
| | | |
A.纸哪吒 | B.石印章 | C.木活字 | D.不锈钢针 |
A. AB. BC. CD. D
2. 在法拉第发现苯200周年之际,我国科学家首次制备了以金属M为中心的多烯环配合物。该配合物具有芳香性,其多烯环结构(如图)形似梅花。该多烯环上
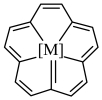
A. ![]() 键是共价键B. 有8个碳碳双键
键是共价键B. 有8个碳碳双键
C. 共有16个氢原子D. 不能发生取代反应
3. 现代科技,增强国力,增进民生福祉。下列说法正确的是
A. 我国科学家首次测得了月球背面月幔水含量![]() 质量为10g
质量为10g
B. 利用![]() 成功为金属材料“重塑金身”,
成功为金属材料“重塑金身”,![]() 中Mo的化合价为+6
中Mo的化合价为+6
C. 穿上电动机械腿,助力行走不是梦,行走时电池将电能转化为化学能
D. 沙海养鱼蹚出治沙新路,让沙海沙山变成金山银山,鱼肉富含蛋白质
4. 劳动创造美好生活。下列对劳动项目涉及![]() 相关化学知识表述错误的是
相关化学知识表述错误的是
选项 | 劳动项目 | 化学知识 |
A | 向燃煤中加入生石灰以脱硫减排 | |
B | 用 | |
C | 使用 | |
D | 用铁粉、活性炭、食盐等制暖贴 | 使用时铁粉被氧化,反应放热 |
A. AB. BC. CD. D
5. 声波封印,材料是音乐存储技术的基础。下列说法错误的是
A. 制作黑胶唱片使用的聚氯乙烯,其单体是![]()
B. 磁带可由四氧化三铁涂覆在胶带上制成,![]() 具有磁性
具有磁性
C. 光碟擦写过程中材料在晶态和非晶态间的可逆转换,涉及物理变化
D. 固态硬盘芯片常使用单晶硅作为基础材料,单晶硅是一种共价晶体
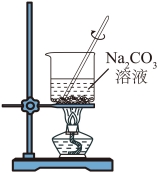
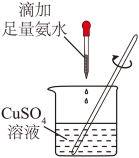
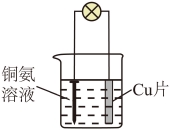
6. 对铁钉进行预处理,并用铜氨溶液给铁钉镀铜。下列操作不能达到实验目的的是
| |
A.除油污 | B.除铁锈 |
| |
C.制铜氨溶液 | D.铁钉镀铜 |
A. AB. BC. CD. D
7. 能满足下列物质间直接转化关系,且推理成立的是
单质X![]() 氧化物1
氧化物1![]() 氧化物2
氧化物2![]() 酸(或碱)
酸(或碱)![]() 盐
盐
A. X可为铝,盐的水溶液一定显酸性
B. X可为硫,氧化物1可使品红溶液褪色
C. X可为钠,氧化物2可与水反应生成![]()
D. X可为碳,盐的热稳定性:![]()
8. 下列陈述Ⅰ与陈述Ⅱ均正确,且两者间具有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 浓硝酸保存在棕色试剂瓶中 | 浓硝酸具有强氧化性 |
B | 向蔗糖中加适量浓硫酸,蔗糖变黑 | 浓硫酸具有脱水性 |
C | | KSCN溶液可用于检验 |
D | | |
A. AB. BC. CD. D
9. 元素a~i为短周期元素,其第一电离能与原子序数的关系如图。下列说法正确的是
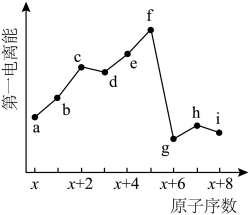
A. a和g同主族B. 金属性:![]()
C. 原子半径:![]() D. 最简单氢化物沸点:
D. 最简单氢化物沸点:![]()
10. 设![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. ![]() 的中子数,比
的中子数,比![]() 的多
的多![]()
B. ![]() 与水蒸气完全反应,生成
与水蒸气完全反应,生成![]() 的数目为
的数目为![]()
C. 在![]() 的
的![]() 溶液中,
溶液中,![]() 的数目为
的数目为![]()
D. 标准状况下的![]() 与足量
与足量![]() 反应,形成的共价键数目为
反应,形成的共价键数目为![]()
11. 利用如图装置进行实验:打开![]() ,一定时间后,a中溶液变蓝;关闭
,一定时间后,a中溶液变蓝;关闭![]() ,打开
,打开![]() ,点燃酒精灯加热数分钟后,滴入无水乙醇。下列说法错误的是
,点燃酒精灯加热数分钟后,滴入无水乙醇。下列说法错误的是

A. a中现象体现了![]() 的还原性
的还原性
B. b中![]() 既作氧化剂也作还原剂
既作氧化剂也作还原剂
C. 乙醇滴加过程中,c中的铜丝由黑变红,说明乙醇被氧化
D. d中有银镜反应发生,说明c中产物有乙酸
12. CuCl微溶于水,但在![]() 浓度较高的溶液中因形成
浓度较高的溶液中因形成![]() 和
和![]() 而溶解。将适量CuCl完全溶于盐酸,得到含
而溶解。将适量CuCl完全溶于盐酸,得到含![]() 和
和![]() 的溶液,下列叙述正确的是
的溶液,下列叙述正确的是
A. 加水稀释,![]() 浓度一定下降
浓度一定下降
B. 向溶液中加入少量NaCl固体,![]() 浓度一定上升
浓度一定上升
C. ![]() 的电离方程式为:
的电离方程式为:![]()
D![]() 体系中,
体系中,![]()
13. 由结构不能推测出对应性质的是
选项 | 结构 | 性质 |
A | | |
B | 钾和钠的原子结构不同,电子跃迁时能量变化不同 | 钾和钠的焰色不同 |
C | 乙烯和乙炔分子均含有 | 两者均可发生加聚反应 |
D | 石墨层中未参与杂化的p轨道中的电子,可在整个碳原子平面中运动 | 石墨具有类似金属的导电性 |
A. AB. BC. CD. D
14. 一种高容量水系电池示意图如图。已知:放电时,电极Ⅱ上![]() 减少;电极材料每转移1mol电子,对应的理论容量为
减少;电极材料每转移1mol电子,对应的理论容量为![]() 。下列说法错误的是
。下列说法错误的是
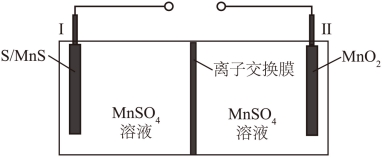
A. 充电时Ⅱ为阳极
B. 放电时Ⅱ极室中溶液的pH降低
C. 放电时负极反应为:![]()
D. 充电时16gS能提供的理论容量为![]()
15. 按如图组装装置并进行实验:将铜丝插入溶液中,当c中红色褪去时,将铜丝拔离液面。下列叙述错误的是
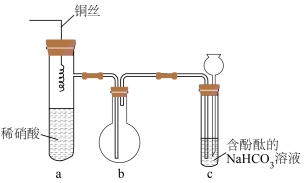
A. a中有化合反应发生,并有颜色变化
B. b中气体变红棕色时,所含氮氧化物至少有两种
C. c中溶液红色刚好褪去时,![]() 恰好完全反应
恰好完全反应
D. 若将a中稀硝酸换![]() 浓硫酸并加热,则c中溶液颜色会褪去
浓硫酸并加热,则c中溶液颜色会褪去
16. 某理论研究认为:燃料电池(图b)的电极Ⅰ和Ⅱ上所发生反应的催化机理示意图分别如图a和图c,其中![]() 获得第一个电子的过程最慢。由此可知,理论上
获得第一个电子的过程最慢。由此可知,理论上

A. 负极反应的催化剂是ⅰ
B. 图a中,ⅰ到ⅱ过程的活化能一定最低
C. 电池工作过程中,负极室的溶液质量保持不变
D. 相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
二、非选择题:本大题共4小题,共56分。考生根据要求作答。
17. 酸及盐在生活生产中应用广泛。
(1)甲苯氧化可生成苯甲酸。向盛有2mL甲苯的试管中,加入几滴酸性![]() 溶液,振荡,观察到体系颜色_______。
溶液,振荡,观察到体系颜色_______。
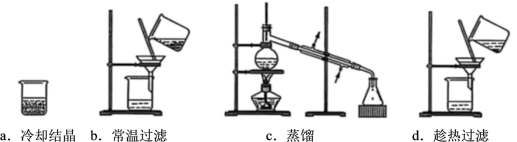
(2)某苯甲酸粗品含少量泥沙和氯化钠。用重结晶法提纯该粗品过程中,需要的操作及其顺序为:加热溶解、_______(填下列操作编号)。
(3)兴趣小组测定常温下苯甲酸饱和溶液的浓度![]() 和苯甲酸的
和苯甲酸的![]() ,实验如下:取50.00mL苯甲酸饱和溶液,用
,实验如下:取50.00mL苯甲酸饱和溶液,用![]() 溶液滴定,用pH计测得体系的pH随滴入溶液体积V变化的曲线如图。据图可得:
溶液滴定,用pH计测得体系的pH随滴入溶液体积V变化的曲线如图。据图可得:
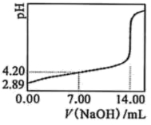
①![]() _______
_______![]() 。
。
②苯甲酸的![]() _______(列出算式,水的电离可忽略)。
_______(列出算式,水的电离可忽略)。
(4)该小组继续探究取代基对芳香酸酸性的影响。
①知识回顾 羧酸酸性可用![]() 衡量。下列羧酸
衡量。下列羧酸![]() 的变化顺序为:
的变化顺序为:![]() 。随着卤原子电负性_______,羧基中的羟基_______增大,酸性增强。
。随着卤原子电负性_______,羧基中的羟基_______增大,酸性增强。
②提出假设 甲同学根据①中规律推测下列芳香酸的酸性强弱顺序为:

③验证假设 甲同学测得常温下三种酸的饱和溶液的pH大小顺序为Ⅲ>Ⅱ>Ⅰ,据此推断假设成立。但乙同学认为该推断依据不足,不能用所测得的pH直接判断![]() 大小顺序,因为_______。
大小顺序,因为_______。
乙同学用(3)中方法测定了上述三种酸的![]() ,其顺序为Ⅱ>Ⅰ>Ⅲ。
,其顺序为Ⅱ>Ⅰ>Ⅲ。
④实验小结 假设不成立,芳香环上取代基效应较复杂,①中规律不可随意推广。
(5)该小组尝试测弱酸HClO的![]() 。
。
①丙同学认为不宜按照(3)中方法进行实验,其原因之一是次氯酸易分解。该分解反应的离子方程式为_______。
②小组讨论后,选用0.100mol/LNaClO溶液(含少量NaCl)进行实验,以获得HClO的![]() 。简述该方案_______(包括所用仪器及数据处理思路)。
。简述该方案_______(包括所用仪器及数据处理思路)。
③教师指导:设计实验方案时,需要根据物质性质,具体问题具体分析。
18. 我国是金属材料生产大国,绿色生产是必由之路。一种从多金属精矿中提取Fe、Cu、Ni等并探究新型绿色冶铁方法的工艺如下。

已知:多金属精矿中主要含有Fe、Al、Cu、Ni、O等元素。
氢氧化物 | | | | |
| | | | |
(1)“酸浸”中,提高浸取速率的措施有_______(写一条)。
(2)“高压加热”时,生成![]() 的离子方程式为:_______。
的离子方程式为:_______。

(3)“沉铝”时,pH最高可调至_______(溶液体积变化可忽略)。已知:“滤液1”中![]() ,
,![]() 。
。
(4)“选择萃取”中,镍形成如图的配合物。镍易进入有机相的原因有_______。

A. 镍与N、O形成配位键B. 配位时![]() 被还原
被还原
C. 配合物与水能形成分子间氢键D. 烷基链具有疏水性
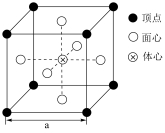
(5)![]() 晶体的立方晶胞中原子所处位置如图。已知:同种位置原子相同,相邻原子间的最近距离之比
晶体的立方晶胞中原子所处位置如图。已知:同种位置原子相同,相邻原子间的最近距离之比![]() ,则
,则![]() _______;晶体中与Cu原子最近且等距离的原子的数目为_______。
_______;晶体中与Cu原子最近且等距离的原子的数目为_______。
(6)①“700℃加热”步骤中,混合气体中仅加少量![]() ,但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为_______和_______。
,但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为_______和_______。
②“电解”时,![]() 颗粒分散于溶液中,以Fe片、石墨棒为电极,在答题卡虚线框中,画出电解池示意图并做相应标注_______。
颗粒分散于溶液中,以Fe片、石墨棒为电极,在答题卡虚线框中,画出电解池示意图并做相应标注_______。
③与传统高炉炼铁工艺相比,上述两种新型冶铁方法所体现“绿色化学”思想的共同点是_______(写一条)。
19. 钛单质及其化合物在航空、航天、催化等领域应用广泛。
(1)基态Ti原子的价层电子排布式为_______。
(2)298K下,反应![]() 的
的![]() 、
、![]() ,则298K下该反应_______(填“能”或“不能”)自发进行。
,则298K下该反应_______(填“能”或“不能”)自发进行。
(3)以![]() 为原料可制备
为原料可制备![]() 。将
。将![]() 与10.0molTi放入容积为
与10.0molTi放入容积为![]() 的恒容密闭容器中,反应体系存在下列过程。
的恒容密闭容器中,反应体系存在下列过程。
编号 | 过程 | |
(a) | | |
(b) | | |
(c) | | |
(d) | | |
①![]() _______kJ/mol。
_______kJ/mol。
②不同温度下,平衡时反应体系![]() 组成如图。曲线Ⅰ对应的物质为_______。
组成如图。曲线Ⅰ对应的物质为_______。
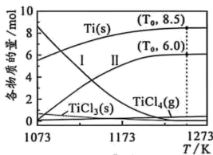
③温度![]() 下,
下,![]() _______
_______![]() ,反应(c)的平衡常数
,反应(c)的平衡常数![]() _______(列出算式,无须化简)。
_______(列出算式,无须化简)。
(4)钛基催化剂可以催化储氢物质肼![]() 的分解反应:
的分解反应:
(e)![]()
(f)![]()
为研究某钛基催化剂对上述反应的影响,以肼的水溶液为原料(含![]() 的物质的量为
的物质的量为![]() ),进行实验,得到
),进行实验,得到![]() 、
、![]() 随时间t变化的曲线如图。其中,
随时间t变化的曲线如图。其中,![]() 为
为![]() 与
与![]() 的物质的量之和;
的物质的量之和;![]() 为剩余
为剩余![]() 的物质的量。设
的物质的量。设![]() 为0~t时间段内反应(e)消耗
为0~t时间段内反应(e)消耗![]() 的物质的量,该时间段内,本体系中催化剂的选择性用
的物质的量,该时间段内,本体系中催化剂的选择性用![]() 表示。
表示。

①![]() 内,
内,![]() 的转化率为_______(用含
的转化率为_______(用含![]() 的代数式表示)。
的代数式表示)。
②![]() 内,催化剂的选择性为_______(用含
内,催化剂的选择性为_______(用含![]() 与
与![]() 的代数式表示,写出推导过程)。
的代数式表示,写出推导过程)。
20. 我国科学家最近在光-酶催化合成中获得重大突破,光-酶协同可实现基于三组分反应的有机合成,其中的一个反应如下(反应条件略:Ph-代表苯基![]() )。
)。
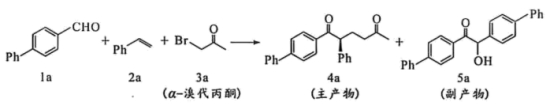
(1)化合物1a中含氧官能团的名称为_______。
(2)①化合物2a的分子式为_______。
②2a可与![]() 发生加成反应生成化合物Ⅰ.在Ⅰ的同分异构体中,同时含有苯环和醇羟基结构的共_______种(含化合物Ⅰ)。
发生加成反应生成化合物Ⅰ.在Ⅰ的同分异构体中,同时含有苯环和醇羟基结构的共_______种(含化合物Ⅰ)。
(3)下列说法正确的有_______。
A. 在1a、2a和3a生成4a的过程中,有![]() 键断裂与
键断裂与![]() 键形成
键形成
B. 在4a分子中,存在手性碳原子,并有20个碳原子采取![]() 杂化
杂化
C. 在5a分子中,有大![]() 键,可存在分子内氢键,但不存在手性碳原子
键,可存在分子内氢键,但不存在手性碳原子
D. 化合物5a是苯酚的同系物,且可发生原子利用率为100%的还原反应
(4)一定条件下,![]() 与丙酮
与丙酮![]() 发生反应,溴取代丙酮中的
发生反应,溴取代丙酮中的![]() ,生成化合物3a.若用核磁共振氢谱监测该取代反应,则可推测:与丙酮相比,产物3a的氢谱图中_______。
,生成化合物3a.若用核磁共振氢谱监测该取代反应,则可推测:与丙酮相比,产物3a的氢谱图中_______。
(5)已知:羧酸在一定条件下,可发生类似于丙酮的![]() 取代反应。根据上述信息,分三步合成化合物Ⅱ。
取代反应。根据上述信息,分三步合成化合物Ⅱ。
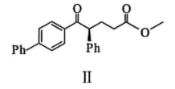
①第一步,引入溴:其反应的化学方程式为_______。
②第二步,进行_______(填具体反应类型):其反应的化学方程式为_______(注明反应条件)。
③第三步,合成Ⅱ:②中得到的含溴有机物与1a、2a反应。
(6)参考上述三组分反应,直接合成化合物Ⅲ,需要以1a、_______(填结构简式)和3a为反应物。
参考答案
一、选择题:本大题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题列出的四个选项中,只有一项符合题目要求。
【1题答案】
【答案】D
【2题答案】
【答案】A
【3题答案】
【答案】D
【4题答案】
【答案】A
【5题答案】
【答案】A
【6题答案】
【答案】D
【7题答案】
【答案】B
【8题答案】
【答案】B
【9题答案】
【答案】B
【10题答案】
【答案】D
【11题答案】
【答案】D
【12题答案】
【答案】A
【13题答案】
【答案】A
【14题答案】
【答案】B
【15题答案】
【答案】C
【16题答案】
【答案】C
二、非选择题:本大题共4小题,共56分。考生根据要求作答。
【17题答案】
【答案】(1)由紫色变为无色
(2)da (3) ①. ![]() ②.
②. ![]()
(4) ①. 增大 ②. 极性 ③. 常温下三种酸的饱和溶液的浓度不同
(5) ①.  ②. 实验方法:取适量0.100mol/LNaClO溶液放入烧杯中,用pH计测得体系在25℃下的pH,记录数据;
②. 实验方法:取适量0.100mol/LNaClO溶液放入烧杯中,用pH计测得体系在25℃下的pH,记录数据;
数据处理思路:由于NaClO溶液中存在ClO-的水解,故根据0.100mol/LNaClO溶液在25℃下的pH可求得ClO-的水解平衡常数![]() ,再利用公式
,再利用公式![]() 求出HClO的Ka。
求出HClO的Ka。
【18题答案】
【答案】(1)搅拌、粉碎多金属精矿、提高酸浸温度等
(2)4Fe2++O2+4H2O![]() 2Fe2O3↓+8H+
2Fe2O3↓+8H+
(3)5 (4)AD
(5) ①. 3:1:1 ②. 12
(6) ①. 2NH3![]() N2+3H2 ②. Fe2O3+3H2
N2+3H2 ②. Fe2O3+3H2![]() 2Fe+3H2O ③.
2Fe+3H2O ③. 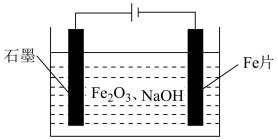 ④. 没有污染物产生
④. 没有污染物产生
【19题答案】
【答案】(1)![]()
(2)能 (3) ①. ![]() ②.
②. ![]() ③. 0.5 ④.
③. 0.5 ④. 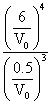
(4) ①. ![]() ②.
②. ![]()
【20题答案】
【答案】(1)醛基 (2) ①. ![]() ②. 5 (3)AB
②. 5 (3)AB
(4)丙酮的单一甲基峰消失,出现两个新信号峰,峰面积之比为3:2,且峰的位置较丙酮左移
(5) ①. ![]() ②. 酯化反应 ③.
②. 酯化反应 ③. ![]()
(6)![]()