2025年江苏连云港中考化学试题及答案
可能用到的相对原子质量:H1C12O16Ca40
四、选择题(本题包括12小题,每小题2分,共24分。每小题只有一个选项符合题意)
24.《中国制造2025》对制造业提出了更高要求。我国最新研发的光控智能粘附材料由H、C、N、Fe等元素组成,其中属于金属元素的是( )
A.HB.CC.ND.Fe
25.酒精(C2H5OH)是医疗及日常生活中的消毒剂。下列对酒精的描述属于化学性质的是( )
A.易挥发
B.无色透明液体
C.燃烧时生成H2O和CO2
D.能与水以任意比例互溶
26.实验室用CaCO3、稀盐酸制取CO2,涉及的装置和操作正确的是( )

A.制取CO2B.除去CO2中HClC.干燥CO2D.收集CO2
阅读下列材料,回答27~29题:
工业合成氨的反应为:N2+3H2 2NH3.NH3是制造硝酸(HNO3)和氮肥(如尿素[CO(NH2)2]、氯化铵等)的重要原料。元素周期表中氮元素的信息如右图所示。
2NH3.NH3是制造硝酸(HNO3)和氮肥(如尿素[CO(NH2)2]、氯化铵等)的重要原料。元素周期表中氮元素的信息如右图所示。

27.下列化学用语表示正确的是( )
A.2个氮原子:N2
B.NH3中氮元素的化合价:![]()
C.HNO3在水中解离出的阳离子:H+
D.氯化铵的化学式:ClNH3
28.下列说法中正确的是( )
A.地壳中氮元素含量最高
B.尿素中含有氮元素
C.氮元素的相对原子质量为14.01g
D.氮原子中质子数和电子数之和等于7
29.工业合成氨的反应属于( )
A.化合反应B.分解反应C.置换反应D.复分解反应
30.厨房中处处有化学。下列厨房中常用物质的性质与用途具有对应关系的是( )
A.食醋有挥发性,可去除水垢
B.氯化钠是白色固体,可作调味品
C.竹炭有吸附性,可作冰箱除味剂
D.碳酸氢钠易溶于水,可作发酵粉
31.青蒿素(C15H22O5)是我国科学家屠呦呦从传统中药中提取的抗疟疾有效成分。下列关于C15H22O5的说法正确的是( )
A.由三种元素组成
B.C、O元素的质量比为3∶1
C.H元素的质量分数最大
D.1个C15H22O5分子中含有11个H2分子
32.下列实验方案能达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 稀释浓硫酸 | 取水倒入浓硫酸中,并用玻璃棒不断搅拌 |
B | 检验H2的纯度 | 用拇指堵住集满H2的试管口,管口向下靠近火焰,移开拇指点火 |
C | 分离CuO和Fe粉 | 加入足量水,溶解,过滤 |
D | 验证Al、Cu、Ag的金属活动性 | 向CuSO4溶液和AgNO3溶液中各放入大小、形状相同的Al片 |
33.80℃时将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体。Na2CO3、Li2SO4、Li2CO3溶解度曲线如题图所示。下列说法正确的是( )
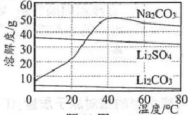
A.Na2CO3的溶解度一定比Li2SO4的大
B.20℃时将Li2SO4饱和溶液升温到40℃时变为不饱和溶液
C.40℃时,60gNa2CO3固体加入100g水中得到160g溶液
D.该制备反应利用了Li2CO3溶解度相对较小的性质
34.工业上生产CaCl2·2H2O的主要流程示意图如题图所示。下列说法正确的是( )
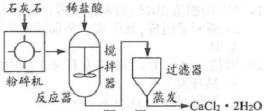
A.石灰石的主要成分是Ca(OH)2
B.粉碎可以增大反应物间的接触面积
C.反应器中加入的稀盐酸可用稀硫酸代替
D.流程中用于分离提纯的设备有搅拌器和过滤器
35.通过数字化实验探究NaOH的性质。
实验1∶在盛有NaOH固体的密闭容器中,水蒸气含量随时间的变化如题图-1所示。
实验2∶取长期放置后的NaOH固体于烧杯中,加水溶解冷却至室温,加入BaCl2固体,溶液pH随时间的变化如题图-2所示。
实验3∶向一定体积NaOH溶液中滴加稀盐酸,混合溶液的pH随加入稀盐酸体积的变化如题图-3所示。
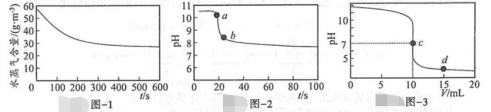
已知∶BaCl2易溶于水,且溶液呈中性。
下列说法正确的是( )
A.题图-1证明NaOH固体能吸收CO2和H2O而变质
B.题图-2中ab段pH下降证明NaOH能与BaCl2发生复分解反应
C.题图-3中向c点所得溶液中滴加无色酚酞溶液,溶液显红色
D.题图-3中d点所得溶液中Na+的个数小于Cl-的个数
五、非选择题(本题包括4小题,共36分)
36.(6分)中华文化源远流长,化学与文化传承密不可分。
(1)《庄子》中记载“木与木相摩则然(燃)”。从燃烧条件分析,“木与木相摩”的取火原理是使可燃物______。
(2)《吕氏春秋》中对青铜有“金(指铜)柔锡柔,合两柔则刚”的记载。古代青铜器的硬度比纯铜______(填“大”或“小”)。
(3)“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句。
①蚕丝属于______(填“天然”或“合成”)纤维。
②“蜡炬成灰”属于______(填“物理变化”或“化学变化”)。
(4)《富春山居图》是元代水墨画。此画能保存至今而不变色的原因是______。
(5)《天工开物》记载了我国古代利用天然气熬制井盐(主要成分为NaCl)。下列说法正确的是______(填字母)。
a.天然气燃烧吸收能量
b.天然气属于纯净物
c.熬制井盐经过蒸发结晶过程
37.(10分)自然界中的碳氧循环是人类生存的基础。
(1)绿色植物的光合作用可吸收CO2放出O2,反应∶6CO2+6X C6H12O6+6O2.
C6H12O6+6O2.
①C6H12O6属于______(填字母)。
a.有机物
b.无机物
c.氧化物
②化合物X的化学式为______。
(2)化石能源的燃烧、人和动物的呼吸作用消耗O2,产生CO2.
①下列关于化石能源的说法正确的是______(填字母)。
a.化石能源只能通过燃烧加以利用
b.石油炼制可得到煤气、汽油和石蜡等多种产品
c.与燃煤相比,使用天然气可以减少SO2、氮氧化物等排放
②某化学小组同学为比较人体吸入的气体与呼出的气体中CO2、O2含量高低,实验如下∶
取4个相同的集气瓶,分别编号A、B、C、D。其中A、B用玻璃片盖好;C和D通过排水集气法收集两瓶呼出的气体,备用。完成下表∶
实验内容 | 现象 | 结论 |
向A、C中分别滴加等量的澄清石灰水,振荡,观察现象。 | A中无明显现象,C中(ⅰ)______。 | 呼出气体中的CO2含量大于空气中CO2含量。 |
将燃着的小木条分别伸入B、D中,观察现象。 | B中无明显现象,D中燃着的木条熄灭。 | 呼出气体中,O2含量(ⅱ)______。 |
(3)实现碳中和意义重大。燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
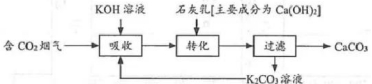
①“吸收”中所得的KHCO3溶液与石灰乳反应的化学方程式为______。
②“过滤”得到的K2CO3溶液能循环利用的原因是______。
③工业上常用高温煅烧CaCO3制取CO2并获取CaO。理论上获取1.1吨CO2时能生产CaO多少吨?______。(写出计算过程,否则不得分!)
38.(9分)“鱼浮灵”是水产养殖中常见增氧剂,主要成分是过碳酸钠(2Na2CO3·3H2O2),遇水分解为Na2CO3和H2O2,能快速增加水体中溶解氧。学习小组对增氧原理进行探究。
已知∶溶解氧是指水溶液中溶解O2的浓度,单位mg·L-1,可用溶解氧传感器测定。
【猜想】
(1)“鱼浮灵”溶于水后,能快速增加水体中溶解氧的物质是什么?
猜想一∶Na2CO3溶液。猜想二∶______。猜想三∶Na2CO3溶液和H2O2溶液协同作用。
【实验】
实验Ⅰ∶配制一定质量分数的过碳酸钠溶液,测量其pH。向过碳酸钠溶液中加入少量MnO2,有无色气体生成,该气体能使带火星木条复燃。反应后将混合物过滤,向滤液中加足量盐酸有无色气体产生。
(2)下列仪器在配制溶液过程中无需使用的是______(填字母)。
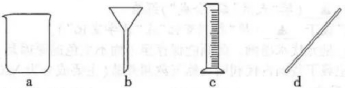
(3)室温下,测得过碳酸钠溶液的pH=10.5,说明其溶液呈______性。
(4)由实验Ⅰ可知,过碳酸钠溶液中能使水体增氧(产生O2)的物质为______。
实验Ⅱ∶室温下,在相同时间内用溶解氧传感器测量80mL的下列试剂,测得下表数据。
实验序号 | ⅰ | ⅱ | ⅲ | ⅳ |
测量试剂 | 水 | 4%Na2CO3溶液 | 4%H2O2溶液 | 4%H2O2溶液+2gNa2CO3 |
溶解氧/mg·L-1 | 4.6 | 4.4 | 6.5 | 9.1 |
【结论】
(5)由实验Ⅰ、Ⅱ得出的结论是∶猜想______(填“一”或“二”或“三”)正确。
【反思】
已知∶①在一定pH范围内,pH越大水体中的H2O2越易分解,溶解氧越大。
②Na2CO3溶液呈碱性,主要原因是溶液中部分CO32-与水反应生成HCO3-和OH-。质量分数相同的NaOH溶液和Na2CO3溶液,NaOH溶液pH大。
(6)为验证溶液pH对H2O2分解的影响,还需补充完整以下实验方案∶室温下,各取80mL4%的H2O2溶液于两只烧杯中,向烧杯中分别加入______,在相同时间内用溶解氧传感器测定烧杯中溶液的溶解氧。(实验中必须使用的试剂∶NaCl、NaOH)
(7)从微观粒子变化角度分析过碳酸钠溶于水后能快速增加水体中溶解氧的原因∶______。
39.(11分)氢气的发现、制取、储存和利用意义重大。
(1)发现氢气:16世纪科学家就发现稀H2SO4与Fe反应能生成“易燃空气”。1787年拉瓦锡将H2O(g)[表示水蒸气]通过一根烧红的铁制枪管,得同样“易燃空气”。他将“易燃空气”命名为“生成水的元素”,即氢。拉瓦锡实验中,枪管内壁有黑色固体(Fe3O4)生成,该反应的化学方程式为______。
(2)制取氢气:一种以NiFe2O4为催化剂制氢的反应原理如题图-1所示。
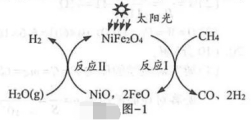
①反应Ⅰ中NiFe2O4______(填“参加”或“未参加”)化学反应。
②将16gCH4和足量的H2O(g)通过该方法制氢,理论上可获得______gH2.
(3)储存氢气:镁基材料固态储氢具有储量大、安全等优点。储氢时,Mg与H2在一定条件下反应生成MgH2固体。1m3镁基材料储存的H2在常温常压下体积可达1345m3.
①MgH2由两种离子按个数比1:2构成。构成MgH2的是Mg2+和______(填离子符号)。
②镁基材料储氢量大的原因是______。
(4)利用氢气:氢氧燃料电池能将化学能转化为电能,工作原理如题图-2所示。

①质子交换膜中只允许一种微观粒子通过,该微观粒子为______(填字母)。
a.e-b.H+c.O2-
②燃料电池中发生反应的化学方程式为______。
参考答案
四、选择题(本题包括12小题,每小题2分,共24分。每小题只有一个选项符合题意)
题号 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 |
答案 | D | C | A | C | B | A | C | A | B | D | B | D |
五、非选择题(本题包括4小题,共36分)
36.(6分)
(1)温度达到着火点
(2)大
(3)①天然
②化学变化
(4)墨的主要成分是碳单质,碳单质在常温下化学性质稳定
(5)c
37.(10分)
(1)①a
②![]()
(2)①c
②(ⅰ)澄清石灰水变浑浊
(ⅱ)小于空气中O2含量
(3)①![]()
②能与CO2反应生成KHCO3
③设∶获取1.1吨CO2时,理论上能生产CaO的质量为![]() 。
。
![]()
56 44
![]() 1.1吨
1.1吨
![]()
![]() 吨
吨
答∶获取1.1吨CO2时,理论上能生产生石灰的质量为1.4吨。
38.(9分)
(1)![]() 溶液
溶液
(2)b
(3)碱
(4)![]()
(5)三
(6)2gNaCl和2gNaOH固体溶解,冷却至室温
(7)部分![]() 与水反应生成
与水反应生成![]() ,
,![]() 促进
促进![]() 分解为O2
分解为O2
39.(11分)
(1)![]()
(2)①参加
②6
(3)①![]()
②![]() 转化为固体,等质量气体体积可缩小1000多倍
转化为固体,等质量气体体积可缩小1000多倍
(4)①b
②![]()
本试卷其他合理答案均可等值赋分。?
