1.化学与生活密切相关,下列不涉及化学变化的是( )
A.加入明矾后泥水变澄清 B.北京冬奥会用水快速制冰
C.炖排骨汤时加点醋味道更鲜 D.切开的茄子放置后切面变色
2.莲藕含多酚类物质,其典型结构简式如图所示。下列有关该类物质的说法错误的是( )

A.不能与溴水反应 B.可用作抗氧化剂
C.有特征红外吸收峰 D.能与![]() 发生显色反应
发生显色反应
3.武当山金殿是铜铸鎏金大殿。传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是( )
A.鎏金工艺利用了汞的挥发性 B.鎏金工艺中金发生了化学反应
C.鎏金工艺的原理可用于金的富集 D.用电化学方法也可实现铜上覆金
4.下列各组离子在给定溶液中能大量共存的是( )
A.在![]() 氨水中:
氨水中:![]()
B.在![]() 氯化钠溶液中:
氯化钠溶液中:![]()
C.在![]() 醋酸溶液中:
醋酸溶液中:![]()
D.在![]() *银溶液中:
*银溶液中:![]()
5.化学物质与生命过程密切相关,下列说法错误的是( )
A.维生素C可以还原活性氧自由基 B.蛋白质只能由蛋白酶催化水解
C.淀粉可用![]() 为原料人工合成 D.核酸可视为核苷酸的聚合产物
为原料人工合成 D.核酸可视为核苷酸的聚合产物
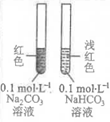
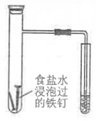
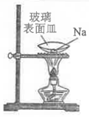
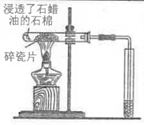
6.下列实验装置(部分夹持装置略)或现象错误的是( )
|
|
|
|
A.滴入酚酞溶液 | B.吸氧腐蚀 | C.钠的燃烧 | D.石蜡油的热分解 |
7.![]() 在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )
在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )
A.具有自范性 B.与![]() 互为同素异形体
互为同素异形体
C.含有![]() 杂化的碳原子 D.化学性质与金刚石有差异
杂化的碳原子 D.化学性质与金刚石有差异
8.硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备:

下列说法正确的是( )
A.![]() 不能被氧化 B.
不能被氧化 B.![]() 溶液显碱性
溶液显碱性
C.该制备反应是熵减过程 D.![]() 的热稳定性比
的热稳定性比![]() 的高
的高
9.某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
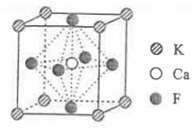
A.![]() 的配位数为6 B.与
的配位数为6 B.与![]() 距离最近的是
距离最近的是![]()
C.该物质的化学式为![]() D.若
D.若![]() 换为
换为![]() ,则晶胞棱长将改变
,则晶胞棱长将改变
10.![]() 和
和![]() 的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )
的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )
A.![]() 与
与![]() 都能在水中与氨形成配合物
都能在水中与氨形成配合物
B.![]() 和
和![]() 的熔点都比
的熔点都比![]() 的低
的低
C.![]() 和
和![]() 均可表现出弱酸性
均可表现出弱酸性
D.![]() 和
和![]() 的氢化物都不能在酸中稳定存在
的氢化物都不能在酸中稳定存在
11.磷酰三叠氮是一种高能分子,结构简式为![]() 。下列关于该分子的说法正确的是( )
。下列关于该分子的说法正确的是( )
A.为非极性分子 B.立体构型为正四面体形
C.加热条件下会分解并放出![]() D.分解产物
D.分解产物![]() 的电子式为
的电子式为![]()
12.根据酸碱质子理论,给出质子![]() 的物质是酸,给出质子的能力越强,酸性越强。
的物质是酸,给出质子的能力越强,酸性越强。
已知:


下列酸性强弱顺序正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
13.同位素示踪是研究反应机理的重要手段之一。已知醛与![]() 在酸催化下存在如下平衡:
在酸催化下存在如下平衡:![]() 。据此推测,对羟基苯甲醛与10倍量的
。据此推测,对羟基苯甲醛与10倍量的![]() 在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )
在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14.含磷有机物应用广泛。电解法可实现由白磷直接制备![]() ,过程如图所示(
,过程如图所示(![]() 为*)。下列说法正确的是( )
为*)。下列说法正确的是( )

A.生成![]() ,理论上外电路需要转移
,理论上外电路需要转移![]() 电子
电子
B.阴极上的电极反应为: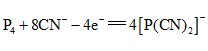
C.在电解过程中![]() 向铂电极移动
向铂电极移动
D.电解产生的![]() 中的氢元素来自于
中的氢元素来自于![]()
15.下图是亚*![]() 和酒石酸
和酒石酸![]() 混合体系中部分物种的
混合体系中部分物种的![]() 图(浓度:总
图(浓度:总![]() 为
为![]() ,总T为
,总T为![]() )。下列说法错误的是( )
)。下列说法错误的是( )

A.![]() 的
的![]() 为
为![]()
B.![]() 的酸性比
的酸性比![]() 的强
的强
C.![]() 时,
时,![]() 的浓度比
的浓度比![]() 的高
的高
D.![]() 时,溶液中浓度最高的物种为
时,溶液中浓度最高的物种为![]()
16.(14分)
高技术领域常使用高纯试剂。纯磷酸(熔点为![]() ,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于![]() 易形成
易形成![]() (熔点为
(熔点为![]() ),高于
),高于![]() 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
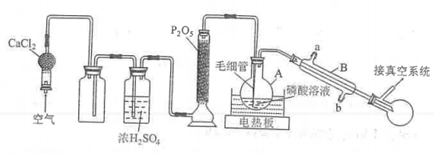
回答下列问题:
(1)A的名称是____________。B的进水口为____________(填“a”或“b”)。
(2)![]() 的作用是____________。
的作用是____________。
(3)空气流入毛细管的主要作用是防止____________,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是____________。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入____________促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为____________(填标号)。
A.![]() B.
B.![]() C.
C.![]()
(7)磷酸中少量的水极难除去的原因是____________。
17.(14分)
化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:

回答下列问题:
(1)![]() 的反应类型是____________。
的反应类型是____________。
(2)化合物B核磁共振氢谱的吸收峰有____________组。
(3)化合物C的结构简式为____________。
(4)![]() 的过程中,被还原的官能团是____________,被氧化的官能团是____________。
的过程中,被还原的官能团是____________,被氧化的官能团是____________。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有____________种。
(6)已知![]() 、
、![]() 和
和![]() 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则![]() 的总产率为____________。
的总产率为____________。
(7)![]() 配合物可催化
配合物可催化![]() 转化中
转化中![]() 键断裂,也能催化反应①:
键断裂,也能催化反应①:
反应①: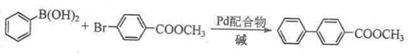
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子![]() (结构如下图所示)。在合成
(结构如下图所示)。在合成![]() 的过程中,甲组使用了
的过程中,甲组使用了![]() 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除![]() ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
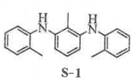
根据上述信息,甲、乙两组合成的![]() 产品催化性能出现差异的原因是____________。
产品催化性能出现差异的原因是____________。
18.(13分)
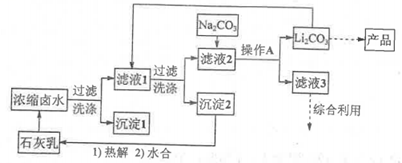
全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有![]() 和少量
和少量![]() ),并设计了以下流程通过制备碳酸锂来提取锂。
),并设计了以下流程通过制备碳酸锂来提取锂。
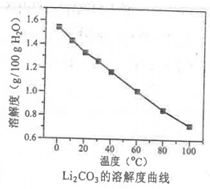
![]() 时相关物质的参数如下:
时相关物质的参数如下:
![]() 的溶解度:
的溶解度:![]()
化合物 |
|
|
|
|
|
|
|
|
|
回答下列问题:
(1)“沉淀1”为____________。
(2)向“滤液1”中加入适量固体![]() 的目的是____________。
的目的是____________。
(3)为提高![]() 的析出量和纯度,“操作A”依次为____________、____________、洗涤。
的析出量和纯度,“操作A”依次为____________、____________、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备![]() 。查阅资料后,发现文献对常温下的
。查阅资料后,发现文献对常温下的![]() 有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究
有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究![]() 的性质,将饱和
的性质,将饱和![]() 溶液与饱和
溶液与饱和![]() 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下![]() ____________(填“稳定”或“不稳定”),有关反应的离子方程式为____________。
____________(填“稳定”或“不稳定”),有关反应的离子方程式为____________。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入![]() 改为通入
改为通入![]() 。这一改动能否达到相同的效果,作出你的判断并给出理由____________。
。这一改动能否达到相同的效果,作出你的判断并给出理由____________。
19.(14分)
自发热材料在生活中的应用日益广泛。某实验小组为探究“![]() ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(![]() )随时间(t)的变化曲线,如图所示。
)随时间(t)的变化曲线,如图所示。
实验编号 | 反应物组成 |
|
a |
|
b |
|
c |
|
d |
|
e |
|
回答下列问题:
(1)已知:
①
②
③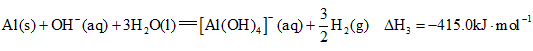
则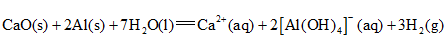 的
的![]() ____________
____________![]() 。
。
(2)温度为T时,![]() ,则
,则![]() 饱和溶液中
饱和溶液中![]() ____________(用含x的代数式表示)。
____________(用含x的代数式表示)。
(3)实验a中,![]() 后
后![]() 基本不变,原因是____________。
基本不变,原因是____________。
(4)实验b中,![]() 的变化说明
的变化说明![]() 粉与
粉与![]() 在该条件下____________(填“反应”或“不反应”)。实验c中,前
在该条件下____________(填“反应”或“不反应”)。实验c中,前![]() 的
的![]() 有变化,其原因是____________;
有变化,其原因是____________;![]() 后
后![]() 基本不变,其原因是____________微粒的量有限。
基本不变,其原因是____________微粒的量有限。
(5)下列说法不能解释实验d在![]() 内温度持续升高的是____________(填标号)。
内温度持续升高的是____________(填标号)。
A.反应②的发生促使反应①平衡右移 B.反应③的发生促使反应②平衡右移
C.气体的逸出促使反应③向右进行 D.温度升高导致反应速率加快
(6)归纳以上实验结果,根据实验e的特征,用文字简述其发热原理____________。
![]()
1. B2. A3. B4. C5. B6. C7. A8. B9. B10. A11. C12. D13. D14. D15. D
16. (1)①. 圆底烧瓶 ②. b
(2)干燥气体 (3)溶液沿毛细管上升
(4)使溶液受热均匀 (5)磷酸晶体
(6)C (7)磷酸可与水分子间形成氢键
17. (1)取代反应(或酯化反应)
(2)5 (3)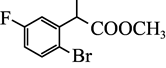
(4) ①. 酯基 ②. 碳碳双键
(5)5 (6)45.92%
(7)甲组使用的Pd催化剂未完全除尽,继续催化反应①
18. (1)Mg(OH)2
(2)将![]() 转化成CaCO3沉淀除去,同时不引入新杂质
转化成CaCO3沉淀除去,同时不引入新杂质
(3) ①. 蒸发浓缩 ②. 趁热过滤
(4) ①. 不稳定 ②. Li+ + HCO![]() = LiHCO3,2LiHCO3 = Li2CO3↓ + CO2↑+ H2O
= LiHCO3,2LiHCO3 = Li2CO3↓ + CO2↑+ H2O
(5)能达到相同效果,因为改为通入过量的![]() ,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3也会很快分解产生Li2CO3,所以这一改动能达到相同的效果
,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3也会很快分解产生Li2CO3,所以这一改动能达到相同的效果
19. (1)-911.9
(2)![]() mol?L-1
mol?L-1
(3)Ca(OH)2在水中的溶解度小,反应①达到了平衡状态
(4) ①. 不反应 ②. Al和溶液中的OH-发生了反应 ③. OH- (5)A
(6)实验e中,发生反应①、②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发生使得溶液中OH-的浓度减小,促使反应②平衡右移,反应②的发生促使反应①平衡右移,这三步反应都是放热反应,温度升高导致反应速率加快。