2023年湖南永州中考化学试题及答案
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5 Ca—40
第Ⅰ卷 选择题(共44分)
一、选择题(本题共22个小题,1~10题为化学试题,11~22题为物理试题,每小题只有一个正确答案。请将正确选项填涂到答题卡上相应的位置。每小题2分,共44分)
1.下列变化中,属于物理变化的是
A.铁锅生锈 B.牛奶变质 C.水结成冰 D.葡萄酿酒
2.空气中能供人呼吸的气体是
A.N2 B.O2 C.CO2 D.Ne
3.规范操作是化学实验成功的基础。下列实验操作正确的是
A. 量筒读数
量筒读数
B. 检查气密性
检查气密性
C.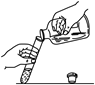 倾倒液体
倾倒液体
D.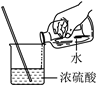 稀释浓硫酸
稀释浓硫酸
4.下列溶液中,溶剂不是水的是
A.稀硫酸 B.生理盐水 C.蔗糖溶液 D.碘的酒精溶液
5.分类是学习和研究化学的常用方法。下列物质属于氧化物的是
A.![]() B.
B.![]() C.CaO D.
C.CaO D.![]()
6.化肥对提高农作物的产量具有重要作用。下列化肥属于复合肥料的是
A.![]() B.
B.![]() C.KCl D.
C.KCl D.![]()
7.下列说法不正确的是
A.溶液pH越大,酸性越强 B.肥皂水可区分软水和硬水
C.小苏打可用于治疗胃酸过多症 D.无色酚酞试液遇NaOH溶液变成红色
8.下列化学方程式书写正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
9.三种金属X、Y、Z相互之间的反应关系如下:
①![]() ,Z和
,Z和![]() 不反应
不反应
②![]()
则X、Y、Z的金属活动性顺序为
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
10.甲、乙两种物质的溶解度曲线如下图所示。下列说法正确的是

A.阴影部分的任意点表明甲、乙两种溶液都是饱和溶液
B.P点时,甲、乙两种溶液的溶质质量分数相等
C.t2℃时,在100g水中加入60g甲,形成不饱和溶液
D.t1℃时,甲、乙的饱和溶液升温至t2℃,溶液的溶质质量分数甲>乙
第Ⅱ卷 非选择题(共76分)
二、非选择题(本题514个小题,23~31题为物理试题,32~36题为化学试题,请将答案填写在答题卡上相应的位置。共76分)
11.铜是我们日常生活中经常接触到的金属材料。图1是铜在元素周期表中的相关信息。图2是铜及其化合物的“价-类二维图”模型。请根据图中信息,回答下列问题:
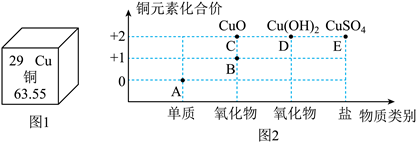
(1)铜的原子序数是______。
(2)A点所对应物质的化学式为______。
(3)B点所对应物质的化学式为![]() ,其中Cu元素的化合价是______价。
,其中Cu元素的化合价是______价。
(4)C、D、E所对应的物质存在下列化学反应,其中属于复分解反应的是______(填序号)。
①![]()
②![]()
12.中国向世界承诺到2060年实现碳中和的气候目标,正在加快氢能、新技术储能、可控核聚变等颠覆性技术攻关及其工业化,为宜居地球和绿色地球贡献中国力量。氢气作为新能源有很多优点,其燃烧后的产物为水,无污染,符合绿色化学的要求,制取和储存![]() 是氢能源利用领域的研究热点。请回答下列问题:
是氢能源利用领域的研究热点。请回答下列问题:
(1)实验室电解水制氢,与电源负极相连的电极产生的气体是______(填“![]() ”或“
”或“![]() ”)。
”)。
(2)工业上一种制取![]() 的方法为
的方法为![]() ,其生成物
,其生成物![]() 和
和![]() 在一种新型催化剂作用下进一步反应,其反应的微观过程模型示意图如图,从该示意图可以判断生成物C与D的分子个数比为______。
在一种新型催化剂作用下进一步反应,其反应的微观过程模型示意图如图,从该示意图可以判断生成物C与D的分子个数比为______。

(3)利用太阳能将水转化为氢能是一种理想的途径,某种光分解水的循环反应过程如图所示。该循环过程中不断消耗的物质是______(填化学式)。

(4)合金![]() 是一种潜在的储氢材料,该合金在一定条件下完全吸氢发生反应:
是一种潜在的储氢材料,该合金在一定条件下完全吸氢发生反应: ![]() ,
,![]() 与水反应生成白色的
与水反应生成白色的![]() 沉淀,并释放出
沉淀,并释放出![]() ,其化学反应方程式为______。
,其化学反应方程式为______。
13.小红同学借助U形管对蜡烛燃烧产物进行创新实验探究,实验装置图(夹持装置略去)如下。
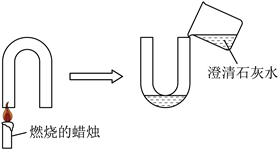
实验操作步骤是:
①准备一个干燥的18mm×180mm的U形管备用;
②点燃固定在桌面的蜡烛,将U形管的一端罩在蜡烛火焰的中上部,观察U形管内壁的实验现象;
③蜡烛燃烧10秒后,将U形管快速倒过来,立即向U形管中注入少量的澄清石灰水.振荡,观察实验现象。
请分析,回答下列问题:
(1)步骤②中,可以观察到U形管内壁的实验现象是_______。
(2)步骤③观察到澄清石灰水变浑浊,其发生反应的化学方程式为_______。
(3)上述实验现象进一步表明,蜡烛中一定含有______、______两种元素(填元素符号)。
(4)小红同学用U形管代替小烧杯做实验,你认为这样做的优点有______(填选项)。
A.便于实验操作 B.实验现象明显 C.产物浓度较低
14.通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。这样得到的粗盐中含有多种可溶性杂质(![]() 、
、![]() 、
、![]() 等)和不溶性杂质(泥沙等)。某化学实验兴趣小组进行粗盐提纯实验。
等)和不溶性杂质(泥沙等)。某化学实验兴趣小组进行粗盐提纯实验。
【查阅资料】NaCl在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
【交流与表达】
(1)本实验除了使用下列玻璃仪器外,还缺少一种多次使用的玻璃仪器是______(填仪器名称)。

(2)用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛有10mL水(密度为1![]() )的烧杯里,边加边搅拌,一直加到粗盐不再溶解为止。用托盘天平称量剩余粗盐的质量,读数如下图所示,其质量是______(填选项)。
)的烧杯里,边加边搅拌,一直加到粗盐不再溶解为止。用托盘天平称量剩余粗盐的质量,读数如下图所示,其质量是______(填选项)。
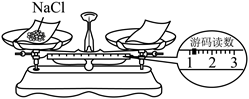
A.0.2g B.1.2g C.2.8g
(3)在进行蒸发操作时,当蒸发皿中出现较多固体时,停止______,利用蒸发皿的余热使滤液蒸干。
(4)实验中是通过蒸发所得溶液中溶剂的方法而不是用降低溶液温度的方法来获取食盐晶体,其理由是_________。
【反思与评价】
(5)如果最后得到精盐的质量为3.3g,则其产率为______(保留小数点后一位)。
(6)实验得到的精盐是______(填“纯净物”或“混合物”)。
15.某化学兴趣小组通过实验测定石灰石中![]() 的含量(假定石灰石中只含有
的含量(假定石灰石中只含有![]() 以及不与稀盐酸反应的杂质)。将50g石灰石加入到过量的稀盐酸中,产生的
以及不与稀盐酸反应的杂质)。将50g石灰石加入到过量的稀盐酸中,产生的![]() 气体通入到足量的NaOH溶液中,测量NaOH溶液增加的质量变化如下图。
气体通入到足量的NaOH溶液中,测量NaOH溶液增加的质量变化如下图。

请回答下列问题:
(1)从上图中可以看出,50g石灰石与过量稀盐酸完全反应后生成![]() 气体的质量为______g(假定
气体的质量为______g(假定![]() 全部被NaOH溶液吸收)。
全部被NaOH溶液吸收)。
(2)计算石灰石中![]() 的质量分数(写出详细的计算过程)。
的质量分数(写出详细的计算过程)。
(3)有同学认为反应的时间![]() ,请分析,该结论______(填“正确”或“不正确”)。
,请分析,该结论______(填“正确”或“不正确”)。
参考答案
1.C
2.B
3.B
4.D
5.C
6.A
7.A
8.B
9.D
10.B
11.(1)29
(2)Cu
(3)+1
(4)①
12.(1)![]()
(2)1:1
(3)H2O
(4)MgH2+2H2O═Mg(OH)2+2H2↑
13.(1)有水雾出现
(2)![]()
(3) H C
(4)B
14.(1)玻璃棒
(2)B
(3)加热
(4)氯化钠的溶解度受温度影响不大
(5)86.8%
(6)混合物
15.(1)17.6
(2)解:设石灰石中CaCO3的质量分数为x

![]()
x=80%
答:石灰石中CaCO3的质量分数为80%。
(3)不正确
